题目内容
5.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
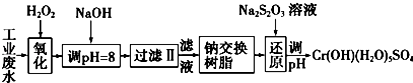
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
分析 I.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为8Cr3+,再调节pH得到Cr(OH)(H2O)5SO4,
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,注意不能引入新的杂质;
(2)根据表中数据判断;通过钠离子交换树脂,除去Ca2+和Mg2+;
(3)每消耗0.8mol Cr2O72-转移4.8mol e-,则1molCr2O72-转移6mol电子,所以生成Cr3+,S2O32-被氧化为SO42-+,结合得失电子守恒和原子守恒写出离子方程式;
II.(1)铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根之间发生反应;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,据此书写方程式;
(3)根据溶度积常数以及水的离子积常数来进行计算.
解答 解:I.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为8Cr3+,再调节pH得到Cr(OH)(H2O)5SO4,
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,同时不能引入新的杂质,所以可以用Na2O2代替H2O2,故答案为:A;
(2)根据表中数据可知,pH=8时,Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、Al3+被除去;通过钠离子交换树脂,除去Ca2+和Mg2+;
故答案为:AB;CD;
(3)每消耗0.8mol Cr2O72-转移4.8mol e-,则1molCr2O72-转移6mol电子,所以生成Cr3+,S2O32-被氧化为SO42-+,则反应的离子方程式为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
II.(1)若用Cu电极来代替Fe电极,在阳极上铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根之间发生反应,
故答案为:不能;因阳极产生的Cu2+不能使Cr2O72-还原到低价态;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(3)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=$\root{3}{\frac{10{\;}^{-32}}{10{\;}^{-5}}}$mol/L=10-9 mol/L,
c(H+)═$\frac{10{\;}^{-14}}{10{\;}^{-9}}$mol/L=10-5mol/L,pH=5,
即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,
故答案为:5.
点评 本题考查了物质分离提纯的操作及方法应用、电解原理、难溶物溶度积的计算等,题目难度较大,涉及的知识点较多,注意掌握电解原理、难溶物溶度积的概念及计算方法,试题培养了学生的分析、理解能力及化学计算能力.

| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)小 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 | |
| C. | 25℃时,在等体积等浓度的氨水、NH4Cl溶液中,Mg(OH)2的Ksp前者小于后者 | |
| D. | 25℃时,在MgF2的悬浊液中通入少量的HF气体,c(Mg2+)减小 |
| A. | Ksp(CaF2)随浓度的变化而变化 | |
| B. | 上述混合体系中有CaF2沉淀生成 | |
| C. | 25℃时,0.1mol/L的HF溶液的pH=l | |
| D. | 上述反应的离子方程式为:Ca2++2F-=CaF2↓ |
| A. | N2 | B. | NH4Cl | C. | HCl | D. | NaCl |
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
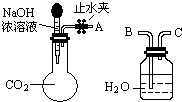 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应.将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶),反应的离子方程式是2OH-+CO2=CO32-+H2O(或CO2+OH-=HCO3-).若其它操作不变,将A与C连接,可观察到的现象是广口瓶中的长导管口有气泡产生.
(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3g白色固体,该白色固体的组成是NaOH和Na2CO3(写化学式).
设计实验确认该白色固体中存在的阴离子,试完成下列方案.
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | 产生白色沉淀 | 有CO32- |
| ②过滤,取2mL滤液于试管中 | ||
| ③滴加酚酞 | 溶液变红 | 有OH- |
| A. | CH4 | B. | C3H8O | C. | C2H4O2 | D. | CH2O |
| A. | S8转化为S6、S4、S2属于物理变化 | |
| B. | 不论哪种硫分子,完全燃烧时都生成SO3 | |
| C. | S8分子中硫原子的杂化方式是sp3杂化 | |
| D. | 把硫单质在空气中加热到750℃即得S2 |
