题目内容
14.有机化合物中ω(C)=60%,ω(H)=13.33%,0.2mol该有机物的质量为12g,则它的分子式为( )| A. | CH4 | B. | C3H8O | C. | C2H4O2 | D. | CH2O |
分析 该有机物的摩尔质量=$\frac{12g}{0.2mol}$=60g/mol,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为60,C原子个数=$\frac{60×60%}{12}$=3,H原子个数=$\frac{60×13.33%}{1}$=8,据此确定化学式.
解答 解:该有机物的摩尔质量=$\frac{12g}{0.2mol}$=60g/mol,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为60,C原子个数=$\frac{60×60%}{12}$=3,H原子个数=$\frac{60×13.33%}{1}$=8,则符合条件的只有C3H8O,故选B.
点评 本题考查有机物分子式的确定,为高频考点,明确各个物理量之间的关系式是解本题关键,侧重考查学生分析计算能力,知道摩尔质量与相对分子质量的关系,题目难度不大.

练习册系列答案
相关题目
5.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
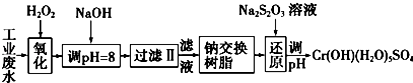
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
Ⅰ.(1)氧化过程中可代替H2O2加入的试剂是A(填序号).
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
9.丁晴橡胶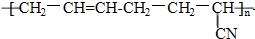 具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )
具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )
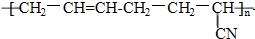 具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )
具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )| A. | 1种 加聚反应 | B. | 2种 缩聚反应 | C. | 2种 加聚反应 | D. | 3种 缩聚反应 |
4.为了更好地表示溶液地酸碱性,科学家提出了酸度(AG)的概念,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,则下列叙述正确的是( )
| A. | 中性溶液AG=0 | |
| B. | 常温下0.1mol/L氢氧化钠溶液的AG=12 | |
| C. | 酸性溶液AG<0 | |
| D. | 常温下0.1mol/L的盐酸溶液的AG=13 |
1.下列关于阿伏伽德罗常数(NA)的说法正确的是( )
| A. | 37g37Cl2中含有20 NA个质子 | B. | 18 g 2H216O中含有10 NA个电子 | ||
| C. | 26Mg2+中含有10 NA个电子 | D. | 1mol18O中含有10 NA个中子 |
2.下列说法正确的是( )
| A. | 氟化铵的电子式: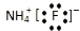 | |
| B. | 原子最外层只有1个电子的元素一定是金属元素 | |
| C. | 离子结构示意图: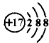 ,可以表示35Cl-,也可以表示37Cl- ,可以表示35Cl-,也可以表示37Cl- | |
| D. | 1mol CH4与1mol NH4+所含质子数相等 |