题目内容
13.常温下单质硫主要以S8(皇冠形结构)形式存在.加热时,S8会转化为S6、S4、S2等,当温度达到750℃时,硫蒸气主要以S2形式存在(占92%).下列说法中正确的是( )| A. | S8转化为S6、S4、S2属于物理变化 | |
| B. | 不论哪种硫分子,完全燃烧时都生成SO3 | |
| C. | S8分子中硫原子的杂化方式是sp3杂化 | |
| D. | 把硫单质在空气中加热到750℃即得S2 |
分析 A.有新物质生成的变化为化学变化,没有新物质生成的变化为物理变化;
B.硫单质燃烧生成二氧化硫;
C.S8为皇冠形结构,每个S与2个其它S原子相连,且还含有2对孤电子对,所以每个S原子价层电子对个数是4;
D.硫单质在空气中加热时,硫单质会和氧气发生反应.
解答 解:A.有新物质生成的变化为化学变化,没有新物质生成的变化为物理变化,这几种硫单质互为同素异形体,在转化过程中有新物质生成,属于化学变化,故A错误;
B.硫单质燃烧生成二氧化硫,所以不论哪种硫分子,完全燃烧时都生成SO2,故B错误;
C.S8为皇冠形结构,每个S与2个其它S原子相连,且还含有2对孤电子对,所以每个S原子价层电子对个数是4,根据价层电子对互斥理论知,S8分子中硫原子的杂化方式是sp3杂化,故C正确;
D.硫单质在空气中加热时,硫单质会和氧气发生反应,所以不会得到纯净的硫单质,故D错误;
故选C.
点评 本题以硫为载体考查化学变化和物理变化区别、原子杂化方式判断、单质性质,为高频考点,明确基本概念、价层电子对互斥理论、物质性质是解本题关键,易错选项是C,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
5.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
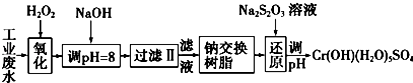
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
Ⅰ.(1)氧化过程中可代替H2O2加入的试剂是A(填序号).
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
4.为了更好地表示溶液地酸碱性,科学家提出了酸度(AG)的概念,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,则下列叙述正确的是( )
| A. | 中性溶液AG=0 | |
| B. | 常温下0.1mol/L氢氧化钠溶液的AG=12 | |
| C. | 酸性溶液AG<0 | |
| D. | 常温下0.1mol/L的盐酸溶液的AG=13 |
1.下列关于阿伏伽德罗常数(NA)的说法正确的是( )
| A. | 37g37Cl2中含有20 NA个质子 | B. | 18 g 2H216O中含有10 NA个电子 | ||
| C. | 26Mg2+中含有10 NA个电子 | D. | 1mol18O中含有10 NA个中子 |
8.下列说法正确的是( )
| A. | 石油裂解、石油分馏、煤的干馏都是化学变化 | |
| B. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| C. | 在一定条件下,苯和液溴、硝酸作用生成溴苯、硝基苯都属于取代反应 | |
| D. | 苯和甲苯都不属于芳香烃 |
18.下列溶液中,微粒的浓度关系正确的是( )
| A. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c (CH3COO-)>c(H+)>c(OH-) | |
| B. | 等体积等物质的量浓度NaF 溶液与HF混合:c(Na+)=c(F-)+c(HF) | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-) | |
| D. | c(NH4+)相等的(NH4)2CO3、(NH4)2SO4、(NH4)2Fe(SO4)2三份溶液,其c依次增大 |
5.设NA为阿佛加德罗常数的值,下列说法不正确的是( )
| A. | 常温常压下,1mol氦气含有的原子数为NA | |
| B. | 常温常压下,8g甲烷中含有的电子数为5NA | |
| C. | 22 g CO2 与标准状况下11.2 L O2含有相同分子数 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数 0.5NA |
2.下列说法正确的是( )
| A. | 氟化铵的电子式: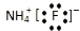 | |
| B. | 原子最外层只有1个电子的元素一定是金属元素 | |
| C. | 离子结构示意图: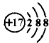 ,可以表示35Cl-,也可以表示37Cl- ,可以表示35Cl-,也可以表示37Cl- | |
| D. | 1mol CH4与1mol NH4+所含质子数相等 |
3.下列各组离子在指定的溶液中能大量共存的是( )
| A. | 透明的溶液中:Al3+、Cu2+、SO42-、NO3- | |
| B. | 通入SO2的溶液中:Fe3+、Ba2+、Cl-、NO3- | |
| C. | 加入铝粉产生H2的溶液中:NH4+、Fe3+、SO42-、NO3- | |
| D. | 常温下,由水电离出的c(H+)=1×10-12mol/L:K+、Ba2+、Cl-、NO3- |