题目内容
16.已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10.现向1L0.2mol/L的HF溶液中加入等体积等浓度的CaCl2溶液.下列说法正确的是( )| A. | Ksp(CaF2)随浓度的变化而变化 | |
| B. | 上述混合体系中有CaF2沉淀生成 | |
| C. | 25℃时,0.1mol/L的HF溶液的pH=l | |
| D. | 上述反应的离子方程式为:Ca2++2F-=CaF2↓ |
分析 A.Ksp只与温度有关,与浓度无关;
B.两溶液混合后,c(Ca2+)=0.1 mol•L-1,c(F-)=$\sqrt{{K}_{a}×c(HF)}$=6×10-3mol/L,再计算浓度积Qc,与溶度积Ksp(CaF2)比较判断;
B.根据氟化钙、碳酸钙的溶度积计算出饱和溶液中溶解的碳酸钙、氟化钙的浓度;
C.HF为弱酸,不能完全电离;
D.氟化氢为弱酸,离子方程式中不能拆开.
解答 解:A.Ksp只与温度有关,则Ksp(CaF2)随温度的变化而变化,与浓度无关,故A错误;
B.两溶液混合后,c(Ca2+)=0.1 mol•L-1,c(F-)=$\sqrt{{K}_{a}×c(HF)}$=6×10-3mol/L,则Qc=c2(F-)•c(Ca2+)=(3.6×10-5mol/L)•0.1 mol•L-1=3.6×10-6>Ksp,说明有沉淀产生,故B正确;
C.HF酸为弱酸,不能完全电离,则25℃时,0.1 mol•L-1HF溶液中pH>1,故C错误;
D.氢氟酸为弱酸,离子方程式中氟化氢不能拆开,正确的离子方程式为:Ca2++2HF=CaF2↓+2H+,故D错误;
故选B.
点评 本题考查了难溶物溶解平衡及其应用,题目难度中等,明确难溶物溶解平衡的概念及影响因素为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
7.下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①Ca(HCO3)2②Al(OH)3③NaAlO2④(NH4)2CO3 ⑤Al.
①Ca(HCO3)2②Al(OH)3③NaAlO2④(NH4)2CO3 ⑤Al.
| A. | ①④ | B. | ②③⑤ | C. | ①②④⑤ | D. | 全部 |
11.键线式可以简明扼要地表示碳氢化合物,键线式为 的物质是( )
的物质是( )
 的物质是( )
的物质是( )| A. | 丙烷 | B. | 丁烷 | C. | 丙烯 | D. | 丁烯 |
1.下列说法正确的是( )
| A. | 饱和烃就是烷烃 | |
| B. | 随着碳原子数的递增,烷烃的熔沸点逐渐降低 | |
| C. | 取代反应中可能有单质生成 | |
| D. | 任何烷烃分子都不可能为平面结构 |
5.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
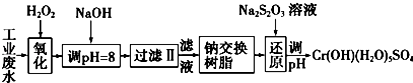
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
Ⅰ.(1)氧化过程中可代替H2O2加入的试剂是A(填序号).
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
4.为了更好地表示溶液地酸碱性,科学家提出了酸度(AG)的概念,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,则下列叙述正确的是( )
| A. | 中性溶液AG=0 | |
| B. | 常温下0.1mol/L氢氧化钠溶液的AG=12 | |
| C. | 酸性溶液AG<0 | |
| D. | 常温下0.1mol/L的盐酸溶液的AG=13 |