题目内容
20.最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功.具体生产流程如图所示:
请回答下列问题:
(1)操作a的名称是过滤,实验室中进行此操作的非玻璃仪器或用品有铁架台(含铁圈)、滤纸;在实验室中操作b的名称是蒸发浓缩、冷却结晶.
(2)在装置a中还生成两种酸式盐,它们的化学式分别是NH4H2PO4、(NH4)2HPO4.
(3)依题意猜测固体A中一定含有的物质的化学式是CaSO4(结晶部分不写).
(4)“热交换器”是利用“废热”预热参与反应的SO2和O2,除此之外还可利用硫酸工业的“废热”发电.
(5)SO3在吸收塔(填设备名称)中用98%的浓硫酸吸收转化为发烟硫酸.
分析 (1)操作a是把固体与液体分开,应为过滤;过滤需要烧杯、漏斗、玻璃棒、铁架台(含铁圈)、滤纸等;操作b是由溶液中析出晶体,应萃取蒸发浓缩、冷却结晶等操作;磷酸受热容易分解,在结晶时应采用低温蒸发结晶;
(2)装置a中磷酸与氨气发生反应,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4;
(3)由信息可知生产磷铵排放的废渣磷石膏制取硫酸,磷灰石的主要成分是Ca3(PO4)2,在萃取槽中与硫酸发生反应,有磷酸生成,结合流程中硫酸制备,故固体A应为CaSO4;
(4)根据流程,热交换内将二氧化硫转化成三氧化硫,根据二氧化硫转化成三氧化硫的条件回答;
(5)工业上三氧化硫在吸收塔里被浓硫酸吸收转化为发烟硫酸.
解答 解:(1)由向装置a中通入氨气和加入磷酸可知,在装置a中生成磷铵,结合通过操作b、a后有磷铵这种“产物”出现,故操作b为蒸发浓缩、冷却结晶,操作a为过滤,过滤操作需要漏斗、玻璃棒、烧杯、铁架台(含铁圈)和滤纸等仪器,从溶液中析出晶体的方法是:将溶液蒸发浓缩、冷却结晶可得相应晶体,
故答案为:过滤;铁架台(含铁圈)、滤纸;蒸发浓缩、冷却结晶;
(2)装置a中磷酸与氨气发生反应,磷酸是三元酸,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4三种盐,其中(NH4)2HPO4、NH4H2PO4两种酸式盐,
故答案为:(NH4)2HPO4、NH4H2PO4;
(3)由信息可知生产磷铵排放的废渣磷石膏制取硫酸,磷灰石的主要成分是Ca3(PO4)2,在萃取槽中与硫酸发生反应,有磷酸生成,结合流程中硫酸制备,故固体A应为CaSO4,
故答案为:CaSO4;
(4)根据流程,热交换内将二氧化硫转化成三氧化硫,而二氧化硫转化成三氧化硫需要加热,所以“热交换器”是利用“废热”预热即将参与反应的SO2和O2,除此之外还可利用硫酸工业的“废热”取暖或发电等,
故答案为:参与反应的SO2和O2;发电;
(5)工业生产时在吸收塔中用98%的浓硫酸吸收三氧化硫,防止三氧化硫直接溶于水后放出大量的热,从而使水沸腾,产生大量酸雾,影响三氧化硫的吸收,
故答案为:吸收塔; 98%的浓硫酸.
点评 本题考查了物质分离与提纯方法的综合应用,题目难度中等,明确实验目的为解答关键,注意掌握化学实验基本操作方法,试题培养了学生的分析能力及化学实验能力.

| A. | CH4和C3H8 | B. | CH4和C3H4 | C. | C2H4和C2H6 | D. | C2H2和C2H6 |
 的物质是( )
的物质是( )| A. | 丙烷 | B. | 丁烷 | C. | 丙烯 | D. | 丁烯 |
| A. | 将混合气体通过氢氧化钠溶液 | |
| B. | 使混合气体中的乙烯发生加聚反应 | |
| C. | 将混合气体在催化剂条件下跟氢气反应 | |
| D. | 将混合气体通过溴水 |
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
| A. | Na2O、Na2O2都属于氧化物 | B. | H2SO4、CH3COOH都属于酸 | ||
| C. | 烧碱、纯碱都属于碱 | D. | Na2CO3、NaHCO3都属于盐 |
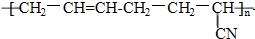 具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )
具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )| A. | 1种 加聚反应 | B. | 2种 缩聚反应 | C. | 2种 加聚反应 | D. | 3种 缩聚反应 |
| A. | 石油裂解、石油分馏、煤的干馏都是化学变化 | |
| B. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| C. | 在一定条件下,苯和液溴、硝酸作用生成溴苯、硝基苯都属于取代反应 | |
| D. | 苯和甲苯都不属于芳香烃 |
