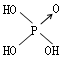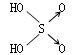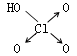题目内容
 常温下,将1mL pH=2的一元酸HA溶液加水稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,将1mL pH=2的一元酸HA溶液加水稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A、加热HA溶液时,溶液酸性增强 |
| B、1 mol?L-1 HA溶液与1 mol?L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(A-),则2<a<4 |
| C、某浓度的NaA溶液的pH=d,则其中由水电离出的c(OH-)=1014-d mol?L-1 |
| D、HA溶液与NaOH溶液恰好完全反应时,c(Na+)>c(A-)>c(OH-)>c(H+) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:若a=4,则HA为强酸,若a<4,则HA为弱酸,不知道a的数值,无法判断HA是强酸还是弱酸,据此分析.
解答:
解:A、若HA为强酸,加热时溶液酸性不变,故A错误;
B、中和后所得溶液为NaA溶液,溶液中c(Na+)>c(A-),说明溶液显碱性,NaA为强碱弱酸盐,则2<a<4,故B正确;
C、某浓度的NaA溶液的pH=d,则其中由水电离出的c(OH-)=10d-14 mol?L-1,故C错误;
D、HA溶液与NaOH溶液恰好完全反应时生成NaA溶液,不知道a的数值,无法判断HA是强酸还是弱酸,NaA不一定显碱性,故D错误;
故选B.
B、中和后所得溶液为NaA溶液,溶液中c(Na+)>c(A-),说明溶液显碱性,NaA为强碱弱酸盐,则2<a<4,故B正确;
C、某浓度的NaA溶液的pH=d,则其中由水电离出的c(OH-)=10d-14 mol?L-1,故C错误;
D、HA溶液与NaOH溶液恰好完全反应时生成NaA溶液,不知道a的数值,无法判断HA是强酸还是弱酸,NaA不一定显碱性,故D错误;
故选B.
点评:本题考查了酸溶液的pH变化与加水稀释的关系,注意强酸与弱酸加水稀释时pH变化不同,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、中和等体积、等物质的量浓度的盐酸和醋酸所消耗的NaOH的物质的量相等 |
| B、若NaHA溶液的pH<7,则H2A一定是强酸 |
| C、将NaOH溶液加入到NH4Cl溶液至中性时,溶液中c(NH4+)=c(Cl一) |
| D、常温下,将pH=11的Ba(OH)2溶液加水稀释10倍后,溶液的pH=12 |
 某同学在研究元素周期表中前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.下列说法中不正确的是( )
某同学在研究元素周期表中前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.下列说法中不正确的是( )| A、离O点越远的元素,其原子半径越大 |
| B、虚线相连的元素处于同一族 |
| C、B元素是图中金属性最强的元素 |
| D、由元素A、B组成的化合物中可能含有共价键 |
下列各组物质的熔、沸点高低只与范德华力有关的是( )
| A、Li、Na、K、Pb |
| B、HF、HCl、HBr、HI |
| C、LiCl、NaCl、KCl、RbCl |
| D、F2、Cl2、Br2、I2 |
实验是研究化学的基础,下图中所示的实验方法、装置或操作均正确的是( )
A、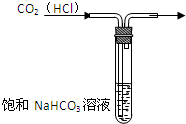 除去混有的杂质气体 |
B、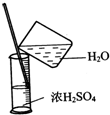 浓硫酸稀释 |
C、 分离出AgNO3溶液中的AgCl |
D、 称量30.46g的NaOH固体 |