题目内容
判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性.由此可推断它们的结构式分别为:
① ② .
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是① ② .
(3)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况,写出化学方程式: .
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 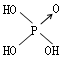 | 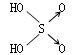 | 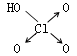 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
①
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①
(3)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况,写出化学方程式:
考点:物质的组成、结构和性质的关系,化学方程式的书写
专题:
分析:(1)含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,据此确定酸的结构式;
(2)酸和碱反应生成盐和水,结合几元酸分析;
(3)显碱性的物质与酸发生反应.
(2)酸和碱反应生成盐和水,结合几元酸分析;
(3)显碱性的物质与酸发生反应.
解答:
解:(1)含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,所以亚磷酸和亚砷酸的结构式分别为: 、
、 ,
,
故答案为: ;
; ;
;
(2)酸和碱反应生成盐和水,亚磷酸中含有2个羟基,属于二元酸,亚砷酸属于三元酸,亚磷酸和亚砷酸分别和氢氧化钠的反应方程式为:H3PO3+2NaOH=Na2HPO3+2H2O、H3AsO3+3NaOH=Na3AsO3+3H2O,
故答案为:H3PO3+2NaOH=Na2HPO3+2H2O;H3AsO3+3NaOH=Na3AsO3+3H2O;
(3)亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,所以亚磷酸和盐酸不反应,亚砷酸和盐酸能反应,反应方程式为As(OH)3+3HCl=AsCl3+3H2O,
故答案为:H3PO3为中强酸,不与盐酸反应,而H3AsO3与盐酸反应为As(OH)3+3HCl=AsCl3+3H2O.
 、
、 ,
,故答案为:
 ;
; ;
;(2)酸和碱反应生成盐和水,亚磷酸中含有2个羟基,属于二元酸,亚砷酸属于三元酸,亚磷酸和亚砷酸分别和氢氧化钠的反应方程式为:H3PO3+2NaOH=Na2HPO3+2H2O、H3AsO3+3NaOH=Na3AsO3+3H2O,
故答案为:H3PO3+2NaOH=Na2HPO3+2H2O;H3AsO3+3NaOH=Na3AsO3+3H2O;
(3)亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,所以亚磷酸和盐酸不反应,亚砷酸和盐酸能反应,反应方程式为As(OH)3+3HCl=AsCl3+3H2O,
故答案为:H3PO3为中强酸,不与盐酸反应,而H3AsO3与盐酸反应为As(OH)3+3HCl=AsCl3+3H2O.
点评:本题考查物质的性质及反应方程式的书写,为高频考点,注意把握习题中的信息及酸性的判断为解答的关键,侧重于学生的分析能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在一定温度下,将气体X和Y各1.6mol充入10L恒容密闭容器中,发生如下反应:X(g)+Y(g)?2Z△H
在反应过程中,X的物质的量与时间的关系如下表所示:下列说法不正确的是( )
在反应过程中,X的物质的量与时间的关系如下表所示:下列说法不正确的是( )
| t/min | 0 | 2 | 4 | 6 | 8 | … | 16 | 18 |
| n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | … | … | 1.000 | 1.000 |
| A、4~6min时间段内Z的平均反应速率为2.5×10-3mol/(L?min) | ||
| B、此温度下该反应的平衡常数K=1.44 | ||
C、达平衡后,升高温度,
| ||
| D、若保持其他条件不变,再充入1.6mol Z,达新平衡后Z的体积分数不变 |
 常温下,将1mL pH=2的一元酸HA溶液加水稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,将1mL pH=2的一元酸HA溶液加水稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A、加热HA溶液时,溶液酸性增强 |
| B、1 mol?L-1 HA溶液与1 mol?L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(A-),则2<a<4 |
| C、某浓度的NaA溶液的pH=d,则其中由水电离出的c(OH-)=1014-d mol?L-1 |
| D、HA溶液与NaOH溶液恰好完全反应时,c(Na+)>c(A-)>c(OH-)>c(H+) |
关于中和热测定实验的下列说法不正确的是( )


| A、烧杯间填满碎泡沫塑料是减少实验过程中的热量损失 |
| B、使用环形玻璃棒既可以搅拌又避免损坏温度计 |
| C、向盛装酸的烧杯中加碱时要小心缓慢 |
| D、测定酸后的温度计要用蒸馏水清洗干燥后再测碱的温度 |
下列说法正确的是( )
A、钾(K)原子基态的原子结构示意图为 |
B、H2O电子式为 |
| C、Mg的原子基态电子排布式为1s22s22p63s23p1 |
| D、Ca2+离子基态电子排布式为1s22s22p63s23p6 |
若某饱和链烃CnH2n+2有同分异构体,则n的最小值为( )
| A、5 | B、4 | C、3 | D、2 |

