题目内容
14.下列各组离子中,因发生氧化还原反应而不能大量共存的是( )| A. | Na+ OH- SO42- HCO3- | B. | OH- NH4+ SO42- Ba2+ | ||
| C. | Fe2+ H+ SO42- NO3- | D. | H+ K+ Cl- HCO3- |
分析 具有还原性的离子与具有氧化性的离子发生氧化还原反应,则不能共存,以此来解答.
解答 解:A.OH-、HCO3-反应生成CO32-和水,没有发生氧化还原反应,故A错误;
B.OH-、NH4+反应生成一水合氨,SO42-、Ba2+反应生成沉淀,没有发生氧化还原反应,故B错误;
C.Fe2+、H+、NO3-发生氧化还原反应而不能大量共存,故C正确;
D.H+、HCO3-反应生成二氧化碳和水,没有发生氧化还原反应,故D错误.
故选C.
点评 本题考查离子的共存,为高频考点,把握常见离子的性质及不能共存的原因为解答的关键,涉及复分解、氧化还原反应的考查,题目难度不大.

练习册系列答案
相关题目
3.布洛芬片常用来减轻普通感冒或流行性感冒引起的发热.布洛芬结构简式如图.下列说法错误的是( )
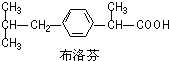

| A. | 布洛芬的分子式C13H18O2 | |
| B. | 布洛芬与苯乙酸(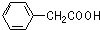 )是同系物 )是同系物 | |
| C. | 布洛芬苯环上的一氯代物有2种 | |
| D. | 常温条件下,1 mol布洛芬完全与金属钠反应可得到1 mol H2 |
2.要鉴别己烯中是否混有少量甲苯,最好的方法是( )
| A. | 先加入足量的高锰酸钾溶液,然后再加溴水 | |
| B. | 加入浓硫酸和浓硝酸后再加热 | |
| C. | 先加入足量的溴水,然后再加入高锰酸钾酸性溶液 | |
| D. | 点燃这种液体,然后再观察火焰的明亮程度 |
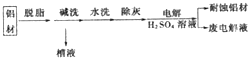
9.环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂.下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂且催化性能相当)

回答下列问题:
(1)环烷烃与相同碳原子数的烯烃(或相对分子质量相同的烯烃)是同分异构体.
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是环丙烷(填名称),判断依据为在都使用催化剂的条件下,加成反应的温度最低.
(3)环烷烃还可与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件下反应,其化学方程式为 (不需注明反应条件)
(不需注明反应条件)
(4)写出鉴别环丙烷与丙烯的一种方法,试剂酸性高锰酸钾溶液;现象与结论使酸性高锰酸钾溶液退色的是丙烯,另一种是环丙烷(或溴水,使溴水退色的是丙烯).
(5)已知某烯烃在酸性高锰酸钾的作用下只产生一种有机物C3H6O,其产物物质的量是原烯烃的两倍且其氢核磁共振谱图上只有一个峰,则该烯烃的结构简式为C(CH3)2=C(CH3)2,系统名称为2,3-二甲基-2-丁烯.
| 结构简式 | 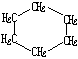 | 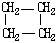 | Br-CH2-CH2-CH(CH3)-CH2-Br |
| 键线式 | 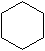 (环己烷) (环己烷) |  (环丁烷) (环丁烷) |  |

回答下列问题:
(1)环烷烃与相同碳原子数的烯烃(或相对分子质量相同的烯烃)是同分异构体.
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是环丙烷(填名称),判断依据为在都使用催化剂的条件下,加成反应的温度最低.
(3)环烷烃还可与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件下反应,其化学方程式为
 (不需注明反应条件)
(不需注明反应条件)(4)写出鉴别环丙烷与丙烯的一种方法,试剂酸性高锰酸钾溶液;现象与结论使酸性高锰酸钾溶液退色的是丙烯,另一种是环丙烷(或溴水,使溴水退色的是丙烯).
(5)已知某烯烃在酸性高锰酸钾的作用下只产生一种有机物C3H6O,其产物物质的量是原烯烃的两倍且其氢核磁共振谱图上只有一个峰,则该烯烃的结构简式为C(CH3)2=C(CH3)2,系统名称为2,3-二甲基-2-丁烯.
19.M元素的一个原子失去两个电子并转移到Y元素的两个原子中,形成离子化合物Z,下列 说法不正确的是( )
| A. | Z的熔点较高 | B. | Z可以表示为M2Y | ||
| C. | Z可能易溶于水 | D. | M形成+2价的阳离子 |
4.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 为延长食品保质期,可向其中大量添加苯甲酸钠等防腐剂 | |
| B. | 催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 以树皮和麻绳为原料所造的纸张其主要成分是纤维素,但纤维素与淀粉不是同分异构体 |