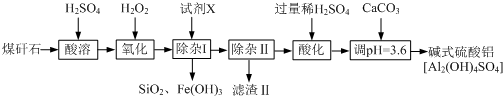
题目内容
3.布洛芬片常用来减轻普通感冒或流行性感冒引起的发热.布洛芬结构简式如图.下列说法错误的是( )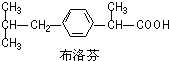
| A. | 布洛芬的分子式C13H18O2 | |
| B. | 布洛芬与苯乙酸(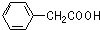 )是同系物 )是同系物 | |
| C. | 布洛芬苯环上的一氯代物有2种 | |
| D. | 常温条件下,1 mol布洛芬完全与金属钠反应可得到1 mol H2 |
分析 A.根据结构简式确定分子式;
B.结构相似、在分子组成上相差一个或n个-CH2原子团的有机物互称同系物;
C.布洛芬苯环结构对称,苯环上有两种氢原子,有几种氢原子,其一氯代物就有几种;
D.能和钠反应的只有羧基.
解答 解:A.根据结构简式确定分子式为C13H18O2,故A正确;
B.结构相似、在分子组成上相差一个或n个-CH2原子团的有机物互称同系物,二者结构相似且在分子组成上相差5个-CH2原子团,所以互为同系物,故B正确;
C.布洛芬苯环结构对称,苯环上有两种氢原子,有几种氢原子,其一氯代物就有几种,所以其苯环上一氯代物有2种,故C正确;
D.能和钠反应的只有羧基,常温条件下,1 mol布洛芬完全与金属钠反应可得到0.5mol H2,故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查基本概念及基本性质,注意羧基和生成氢气计量数关系,为易错点.

练习册系列答案
相关题目
14.NA为阿伏加罗常数的值,下列叙述正确的是( )
| A. | 1molCH3+中含有的电子数为10NA | |
| B. | 1mol铁粉与1mol水蒸气充分反应转移的电子数为3A | |
| C. | 0.1mol/L的Al2(SO4)3溶液中,Al3+的数目小于0.2NA | |
| D. | 电解精炼铜时,若转移了NA个电子,则阴极析出32g铜 |
11.磷石膏是磷氨厂生产硫酸和磷酸所排放的废渣(主要成分为CaSO4•2H2O),大量堆积既占用土地,又易造成环境污染和硫资源的浪费,所以可从资源综合利用的角度将磷石膏转化成硫酸钾和氯化钙晶体,工艺流程如下:
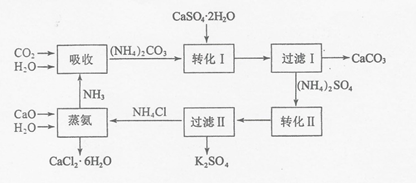
请回答以下问题:
(1)为了提高原料的利用率,吸收流程中通入CO2和NH3的先后顺序最好为先通入NH3,后通入CO2.
(2)碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为CaSO4+CO32-?CaCO3+SO42.
(3)工艺流程中除了所给出的CaCO3、CaSO4•2H2O、NH3、H2O等原料外,在转化Ⅱ的过程中还需要加入KCl原料.
(4)①过滤Ⅱ后所得滤液NH4Cl溶液,确认其中含有Cl-的方法是:取滤液少量与试管中,滴加足量的硝酸钡或氢氧化钡至无沉淀生成,静置后取上层清夜少量与另一支试管中,滴加稀硝酸至溶液呈酸性后,再滴加硝酸银溶液,如果有白色沉淀生成,即可证明原滤液中含有氯离子;
②氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是因为ad(选填序号);
A.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
③已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
60℃时K2SO4的饱和溶液945.6g冷却到0℃,可析出K2SO4晶体86.4g.
(5)上述工艺流程中循环利用的物质是NH3;还有一种物质,只要其纯净,也可以被循环利用,它是CaCO3(均填化学式).

请回答以下问题:
(1)为了提高原料的利用率,吸收流程中通入CO2和NH3的先后顺序最好为先通入NH3,后通入CO2.
(2)碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为CaSO4+CO32-?CaCO3+SO42.
(3)工艺流程中除了所给出的CaCO3、CaSO4•2H2O、NH3、H2O等原料外,在转化Ⅱ的过程中还需要加入KCl原料.
(4)①过滤Ⅱ后所得滤液NH4Cl溶液,确认其中含有Cl-的方法是:取滤液少量与试管中,滴加足量的硝酸钡或氢氧化钡至无沉淀生成,静置后取上层清夜少量与另一支试管中,滴加稀硝酸至溶液呈酸性后,再滴加硝酸银溶液,如果有白色沉淀生成,即可证明原滤液中含有氯离子;
②氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是因为ad(选填序号);
A.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
③已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
(5)上述工艺流程中循环利用的物质是NH3;还有一种物质,只要其纯净,也可以被循环利用,它是CaCO3(均填化学式).
8. Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成实验设计表中横线上的内容.
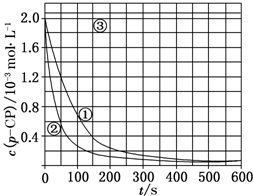
[数据处理]实验测得p-CP的浓度随时间变化的关系如图.
(2)根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1.(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成实验设计表中横线上的内容.
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | |||
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
(2)根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1.(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
14.下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
| A. | Na+ OH- SO42- HCO3- | B. | OH- NH4+ SO42- Ba2+ | ||
| C. | Fe2+ H+ SO42- NO3- | D. | H+ K+ Cl- HCO3- |
15.某有机物的蒸气,完全燃烧时需三倍于其体积的O2,产生二倍于其体积的二氧化碳(相同状况),该有机物可能是( )
| A. | CH4 | B. | C2H5OH | C. | CH3CHO | D. | CH3COOH |