题目内容
19.M元素的一个原子失去两个电子并转移到Y元素的两个原子中,形成离子化合物Z,下列 说法不正确的是( )| A. | Z的熔点较高 | B. | Z可以表示为M2Y | ||
| C. | Z可能易溶于水 | D. | M形成+2价的阳离子 |
分析 元素M的两个原子失去2个电子并转移到元素Y的两个原子上,形成化合物Z,Z为离子化合物,根据原子守恒确定Z的化学式为MY2,结合离子化合物的性质解答该题.
解答 解:A.Z为离子化合物,熔点较高,故A正确;
B.M元素的一个原子失去两个电子并转移到Y元素的两个原子中,M形成阳离子,Y形成阴离子,Z的化学式为MY2,故B错误;
C.Z为离子化合物,不一定溶于水,如CaF2,如为氯化镁,则易溶于水,故C正确;
D.M元素的一个原子失去两个电子并转移到Y元素的两个原子中,形成+2价的阳离子,故D正确.
故选B.
点评 本题考查了原子结构和元素的性质,为高频考点,侧重于学生的分析能力的考查,根据得失电子确定化学键类型,再结合原子结构、物质构成分析解答,题目难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
7.根据元素周期律和物质结构的有关知识,以下有关排序错误的是( )
| A. | 离子半径:S2->Cl->Ca2+ | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
8. Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成实验设计表中横线上的内容.
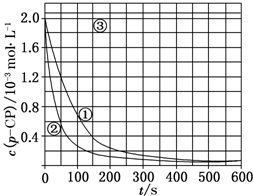
[数据处理]实验测得p-CP的浓度随时间变化的关系如图.
(2)根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1.(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成实验设计表中横线上的内容.
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | |||
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
(2)根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1.(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
7.二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能.也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.请填写下列空白:
(1)二甲醚的核磁共振氢谱图中有1个吸收峰,官能团名称是醚键.
(2)二甲醚的同分异构体A与浓硫酸混合,加热到170℃时生成有机物B:
①写出A的官能团电子式为 ;B与溴水反应生成的物质名称为1,2-二溴乙烷;
;B与溴水反应生成的物质名称为1,2-二溴乙烷;
②德国化学家第尔斯和他的学生阿尔德首次发现和记载一种新型反应而获得1950年诺贝尔化学奖,该反应是一种环加成反应:凡含有双键或三键的不饱和化合物,可以和链状或环状含共轭双烯体系发生1,4加成反应,通常生成一个六元环,该反应条件温和,产率很高,是有机化学合成反应中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一请根据以上信息写出2-甲基-1,3-丁二烯(含共轭双烯体系)与B反应化学方程式CH2=C(CH3)CH=CH2+CH2=CH2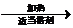
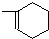 .
.
(3)二甲醚、空气、氢氧化钾溶液、多孔石墨电极构成燃料电池,则负极电极反应式是CH3OCH3+16OH--12e-=2CO32-+11H2O.
(4)反应2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为225.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v(正)> v(逆)(填“>”、“<”或“=”);
②若开始只加入CH3OH,经10min后反应达到平衡,计算达到平衡时CH3OH转化率 α(CH3OH)=96.8%(计算结果用百分数表示,保留小数后一位).
(1)二甲醚的核磁共振氢谱图中有1个吸收峰,官能团名称是醚键.
(2)二甲醚的同分异构体A与浓硫酸混合,加热到170℃时生成有机物B:
①写出A的官能团电子式为
 ;B与溴水反应生成的物质名称为1,2-二溴乙烷;
;B与溴水反应生成的物质名称为1,2-二溴乙烷;②德国化学家第尔斯和他的学生阿尔德首次发现和记载一种新型反应而获得1950年诺贝尔化学奖,该反应是一种环加成反应:凡含有双键或三键的不饱和化合物,可以和链状或环状含共轭双烯体系发生1,4加成反应,通常生成一个六元环,该反应条件温和,产率很高,是有机化学合成反应中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一请根据以上信息写出2-甲基-1,3-丁二烯(含共轭双烯体系)与B反应化学方程式CH2=C(CH3)CH=CH2+CH2=CH2
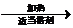
 .
.(3)二甲醚、空气、氢氧化钾溶液、多孔石墨电极构成燃料电池,则负极电极反应式是CH3OCH3+16OH--12e-=2CO32-+11H2O.
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.60 | 0.60 |
①比较此时正、逆反应速率的大小:v(正)> v(逆)(填“>”、“<”或“=”);
②若开始只加入CH3OH,经10min后反应达到平衡,计算达到平衡时CH3OH转化率 α(CH3OH)=96.8%(计算结果用百分数表示,保留小数后一位).
14.下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
| A. | Na+ OH- SO42- HCO3- | B. | OH- NH4+ SO42- Ba2+ | ||
| C. | Fe2+ H+ SO42- NO3- | D. | H+ K+ Cl- HCO3- |
8.核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构为: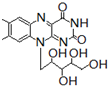
已知: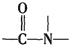 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$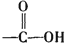 +
+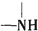 ,有关核黄素的下列说法中,正确的是( )
,有关核黄素的下列说法中,正确的是( )

已知:
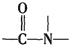 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$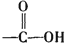 +
+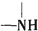 ,有关核黄素的下列说法中,正确的是( )
,有关核黄素的下列说法中,正确的是( )| A. | 该物质属于有机高分子 | B. | 不能发生酯化反应 | ||
| C. | 不能与氢气发生加成反应 | D. | 酸性条件下加热水解,有CO2生成 |
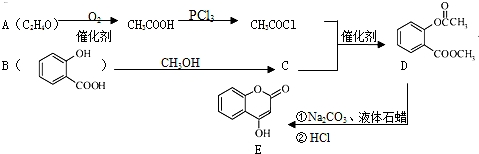
 .
. .
.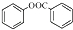 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下: