题目内容
2.我国的能源主要来源于燃煤,煤燃烧产生的烟气直接排放会引起严重的环境问题.将烟气通过石灰浆液的脱硫装置可以除去85%-90%的SO2,且最终会生产出几乎不含杂质的二氧化碳,减少碳排放.其装置如图所示.(1)煤燃烧产生的烟气直接排放到空气中,引发的主要环境问题有BC(填字母)
A.光化学烟雾 B.酸雨 C.粉尘污染 D.水体富营养化
(2)石灰石浆液在进入脱硫装置前,需通入一段时间的二氧化碳,其目的是增大溶液中Ca2+的浓度,提高脱硫效率;脱硫时控制浆液的pH,此时浆液中含有的亚硫酸氢钙被足量氧气快速氧化成硫酸钙的化学方程式为Ca(HSO3)2+O2=CaSO4+H2SO4.
(3)下列措施中,有利于降低大气中CO2浓度的是BC(填字母).
A.增加化石燃料的使用 B.植树造林,增大植被面积
C.采用节能技术 D.大力发展火力发电
(4)将上述回收的CO2转化成有机物可有效实现碳循环.等物质的量的CO2和CH4在催化剂和加热的条件下恰好发生化合反应生成一种常见有机物,写出该反应的化学方程式CO2+CH4$\frac{\underline{催化剂}}{△}$CH3COOH.上述反应的优点是原子利用率高,无副产物产生.
(5)已知某烟气中SO2的浓度为3.2×10-2g/L.若将处理1m3该烟气得到的CaSO4加入燃料反应器中与甲烷充分反应,消耗甲烷7g,则该烟气中SO2的去除率为87.5%(假设脱硫得到的含硫化合物为CaSO4)
分析 (1)煤燃烧产生的烟气含二氧化硫及固体颗粒物;
(2)需通入一段时间的二氧化碳,提高钙离子浓度;亚硫酸氢钙被足量氧气快速氧化成硫酸钙,还生成硫酸;
(3)增加化石燃料的使用、大力发展火力发电均不能减少二氧化碳的排放;
(4)等物质的量的CO2和CH4在催化剂和加热的条件下恰好发生化合反应生成一种常见有机物为乙酸,产物只有一种;
(5)处理1m3该烟气得到的CaSO4加入燃料反应器中与甲烷充分反应,消耗甲烷7g,消耗的二氧化硫为$\frac{\frac{7g}{16g/mol}}{1000L}$×64g/mol,以此计算该烟气中SO2的去除率.
解答 解:(1)煤燃烧产生的烟气含二氧化硫及固体颗粒物,二氧化硫可导致酸雨发生,固体颗粒导致粉尘污染,而光化学烟雾与N的氧化物排放有关,水体富营养化与N、P化合物排放有关,故答案为:BC;
(2)需通入一段时间的二氧化碳,其目的是增大溶液中Ca2+的浓度,提高脱硫效率;亚硫酸氢钙被足量氧气快速氧化成硫酸钙,还生成硫酸,反应为Ca(HSO3)2+O2=CaSO4+H2SO4,
故答案为:增大溶液中Ca2+的浓度,提高脱硫效率;Ca(HSO3)2+O2=CaSO4+H2SO4;
(3)增加化石燃料的使用、大力发展火力发电均不能减少二氧化碳的排放,而植树造林,增大植被面积及采用节能技术均可降低大气中CO2浓度,
故答案为:BC;
(4)等物质的量的CO2和CH4在催化剂和加热的条件下恰好发生化合反应生成一种常见有机物为乙酸,反应为CO2+CH4$\frac{\underline{催化剂}}{△}$CH3COOH,该反应优点为原子利用率高,无副产物产生,
故答案为:CO2+CH4$\frac{\underline{催化剂}}{△}$CH3COOH;原子利用率高,无副产物产生;
(5)处理1m3该烟气得到的CaSO4加入燃料反应器中与甲烷充分反应,消耗甲烷7g,消耗的二氧化硫为$\frac{\frac{7g}{16g/mol}}{1000L}$×64g/mol=2.8×10-2g/L,该烟气中SO2的去除率为$\frac{2.8×1{0}^{-2}}{3.2×1{0}^{-2}}$×100%=87.5%,故答案为:87.5%.
点评 本题考查三废处理及环境保护,为高频考点,把握物质的性质、环境保护及化学反应的应用等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案| A. | 溴化钠的电子式: | B. | 硫原子的结构示意图: | ||
| C. | 氢气分子的电子式: | D. | 水的分子式为H2O |
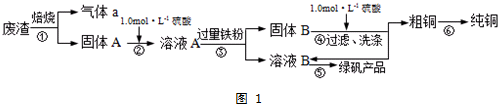
(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
(2)该小组同学设计如图2装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.
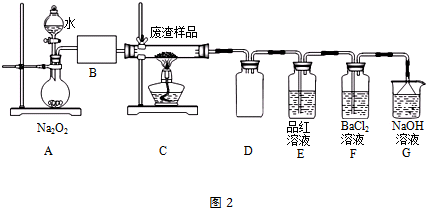
①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作是打开分液漏斗上口瓶塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(3)步骤⑥中由粗铜得到纯铜的方法为电解精炼(填写名称).
(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.(保留三位有效数字)

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co(OH)3发生反应的离子方程式2Co(OH)3+SO32-+4H+=2Co2++SO42-+5H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,则a的范围是5.2≤PH<7.6.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解;
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0〜2.5 B.3.0〜3.5 C.4.0〜4.5 D.5.0〜5.5
(6)操作1为蒸发浓缩、冷却结晶、过滤.
(7)实验室用足量的浓盐酸完全溶解一定量的钴的氧化物Cox0y(其中钴的化合价为+2、+3),若得到含13gCoCl2的溶液并产生标准状况下448mL的黄绿色气体,则y:x=6:5.
| A. | 离子半径:S2->Cl->Ca2+ | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
| A. | 1molCH3+中含有的电子数为10NA | |
| B. | 1mol铁粉与1mol水蒸气充分反应转移的电子数为3A | |
| C. | 0.1mol/L的Al2(SO4)3溶液中,Al3+的数目小于0.2NA | |
| D. | 电解精炼铜时,若转移了NA个电子,则阴极析出32g铜 |
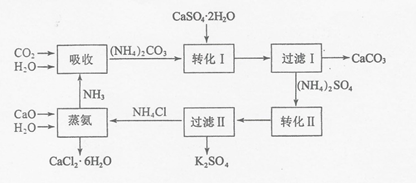
请回答以下问题:
(1)为了提高原料的利用率,吸收流程中通入CO2和NH3的先后顺序最好为先通入NH3,后通入CO2.
(2)碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为CaSO4+CO32-?CaCO3+SO42.
(3)工艺流程中除了所给出的CaCO3、CaSO4•2H2O、NH3、H2O等原料外,在转化Ⅱ的过程中还需要加入KCl原料.
(4)①过滤Ⅱ后所得滤液NH4Cl溶液,确认其中含有Cl-的方法是:取滤液少量与试管中,滴加足量的硝酸钡或氢氧化钡至无沉淀生成,静置后取上层清夜少量与另一支试管中,滴加稀硝酸至溶液呈酸性后,再滴加硝酸银溶液,如果有白色沉淀生成,即可证明原滤液中含有氯离子;
②氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是因为ad(选填序号);
A.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
③已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
(5)上述工艺流程中循环利用的物质是NH3;还有一种物质,只要其纯净,也可以被循环利用,它是CaCO3(均填化学式).
| A. | Na+ OH- SO42- HCO3- | B. | OH- NH4+ SO42- Ba2+ | ||
| C. | Fe2+ H+ SO42- NO3- | D. | H+ K+ Cl- HCO3- |