题目内容
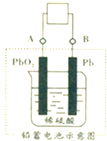 电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-
| 放电 |
| 充电 |
| A、放电时电极 PbO2 发生氧化反应 |
| B、放电时电子流向由A到B |
| C、工作时蓄电池里电解质溶液的pH不变 |
| D、放电时正极反应是PbO2+2e-+4H++SO42-═PbSO4+2H2O |
考点:常见化学电源的种类及其工作原理
专题:电化学专题
分析:放电时,负极反应式为Pb-2e-+SO42-=PbSO4,正极反应式为PbO2+2e-+4H++SO42-═PbSO4+2H2O,充电时阳极、阴极反应式与正极、负极反应式正好相反,据此分析解答.
解答:
解:A.放电时,电极 PbO2得电子发生还原反应,故A错误;
B.放电时,电子从负极沿导线流向正极,Pb是负极、二氧化铅是正极,所以电子从B流向A,故B错误;
C.放电时,硫酸参加反应且生成水,导致硫酸的物质的量减小、溶液体积增大,则溶液浓度减小,溶液的pH增大,故C错误;
D.放电时正极反应是PbO2+2e-+4H++SO42-═PbSO4+2H2O,故D正确;
故选D.
B.放电时,电子从负极沿导线流向正极,Pb是负极、二氧化铅是正极,所以电子从B流向A,故B错误;
C.放电时,硫酸参加反应且生成水,导致硫酸的物质的量减小、溶液体积增大,则溶液浓度减小,溶液的pH增大,故C错误;
D.放电时正极反应是PbO2+2e-+4H++SO42-═PbSO4+2H2O,故D正确;
故选D.
点评:本题考查原电池原理,明确元素化合价变化与正负极的关系是解本题关键,知道电子流向的判断方法、会书写电极反应式,为学习难点,题目难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
t℃时,在2L的密闭容器中存在反应:m A(g)+n B(s)═p C(g)△H=a KJ?mol-1,已知t℃时该反应平衡常数为K,且起始加料如下表所示:下列说法正确的是( )
| A | B | C | |
| 起始加料(mol) | x | y | z |
A、若
| ||
B、若
| ||
| C、若m+n<p,且a<0,则正反应一定可以自发进行 | ||
| D、若m+n>p,则正反应方向是熵减的方向 |
环境友好助洗剂-4A沸石可代替会对水体造成营养化等环境问题的助洗剂聚磷酸钠,4A沸石是一种水合硅铝酸盐,化学式为Na12Al12Si12O48?27H2O,amol 4A沸石与2mol/L的盐酸恰好完全反应时,消耗盐酸的体积为( )
| A、18a L |
| B、24a L |
| C、96a L |
| D、144a L |
下列有关阿伏加德罗常数(NA)的说法错误的是( )
| A、32 g氧气和臭氧的混合气体中所含的原子数为2N. |
| B、常温常压下,22.4LCO2含有的分子数目为NA |
| C、0.1mol OH-含有NA个电子 |
| D、2.4g金属镁与足量的盐酸反应,转移的电子数为0.2NA |
下列物质在水溶液中的电离方程式错误的是( )
| A、NaHSO4═Na++H++SO42- |
| B、NaHCO3═Na++H++CO32- |
| C、MgCl2═Mg2++Cl- |
| D、Ba(OH)2═Ba2++2OH- |
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知反应Fe2O3+3Na2O2
2Na2FeO4+Na2O,下列说法正确的是( )
| ||
| A、Na2O2既是氧化剂又是还原剂 |
| B、Na2FeO4既是氧化产物又是还原产物 |
| C、3 mol Na2O2发生反应,有12mol 电子转移 |
| D、在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
若NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、1 mol NH3与1 mol OH-所含的质子数均为10NA |
| B、标准状况下,22.4L CHCl3中含C-H键数目为NA |
| C、1mol Fe与足量的稀HNO3反应时,转移3NA个电子 |
| D、常温下,pH=13的NaOH溶液中含OH-数目为0.1NA |