题目内容
下列物质在水溶液中的电离方程式错误的是( )
| A、NaHSO4═Na++H++SO42- |
| B、NaHCO3═Na++H++CO32- |
| C、MgCl2═Mg2++Cl- |
| D、Ba(OH)2═Ba2++2OH- |
考点:电离方程式的书写
专题:离子反应专题
分析:A、NaHSO4是强酸强碱的酸式盐,在水溶液中能完全电离;
B、NaHCO3是弱酸强碱的酸式盐,在水溶液中HCO3-不能完全电离;
C、MgCl2能电离出2个氯离子;
D、氢氧化钡是二元强碱.
B、NaHCO3是弱酸强碱的酸式盐,在水溶液中HCO3-不能完全电离;
C、MgCl2能电离出2个氯离子;
D、氢氧化钡是二元强碱.
解答:
解:A、NaHSO4是强酸强碱的酸式盐,在水溶液中能完全电离,故离子方程式为:NaHSO4=Na++H++SO42-,故A正确;
B、NaHCO3是弱酸强碱的酸式盐,在水溶液中HCO3-不能完全电离,故离子方程式应为:NaHCO3=Na++HCO3-,故B错误;
C、MgCl2能电离出2个氯离子,故离子方程式应为:MgCl2=Mg2++2Cl-,故C错误;
D、氢氧化钡是二元强碱,故D正确.
故选BC.
B、NaHCO3是弱酸强碱的酸式盐,在水溶液中HCO3-不能完全电离,故离子方程式应为:NaHCO3=Na++HCO3-,故B错误;
C、MgCl2能电离出2个氯离子,故离子方程式应为:MgCl2=Mg2++2Cl-,故C错误;
D、氢氧化钡是二元强碱,故D正确.
故选BC.
点评:本题考查了物质的电离方程式的书写,应注意的是HCO3-不能完全电离,难度不大.

练习册系列答案
相关题目
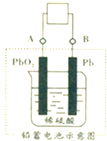 电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-
| 放电 |
| 充电 |
| A、放电时电极 PbO2 发生氧化反应 |
| B、放电时电子流向由A到B |
| C、工作时蓄电池里电解质溶液的pH不变 |
| D、放电时正极反应是PbO2+2e-+4H++SO42-═PbSO4+2H2O |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1 mol甲烷含有的电子数为NA |
| B、1 L 0.1 mol/L Na2CO3溶液中含有的CO3数目为0.1 NA |
| C、1 L pH=1的硫酸溶液中含有的H+数为0.2 NA |
| D、标准状况下,2.24 L CO和CO2混合气体中含有的氧原子数为0.15NA |
化学基本概念的理解和把握是学好化学的关键.下列说法正确的是( )
| A、燃烧热指的是可燃物完全燃烧生成稳定的氧化物所放出的热量 |
| B、勒夏特列原理指的是,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动 |
| C、盐溶液不一定显中性,不显中性的盐都会促进水的电离 |
| D、电镀是利用原电池原理在某些金属表面镀上一薄层其他金属或合金的方法 |
下列有关叙述正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、强电解质溶液的导电能力一定比弱电解质溶液的强 |
| C、SO3溶于水,其水溶液能导电,故SO3是电解质 |
| D、升高温度,可提高活化分子百分数,使有效碰撞几率提高,化学反应速率加快 |
下列解释事实的离子方程式正确的是( )
| A、铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| B、向Ca(ClO)2溶液中通入过量CO2制取次氯酸:2ClO-+H2O+CO2=2HClO+CO32- |
| C、向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O |
| D、0.01 mol?L-1NH4Al(SO4)2溶液与0.02 mol?L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |

