题目内容
t℃时,在2L的密闭容器中存在反应:m A(g)+n B(s)═p C(g)△H=a KJ?mol-1,已知t℃时该反应平衡常数为K,且起始加料如下表所示:下列说法正确的是( )
| A | B | C | |
| 起始加料(mol) | x | y | z |
A、若
| ||
B、若
| ||
| C、若m+n<p,且a<0,则正反应一定可以自发进行 | ||
| D、若m+n>p,则正反应方向是熵减的方向 |
考点:用化学平衡常数进行计算
专题:
分析:A、根据浓度商与平衡常数的大小关系判断平衡向什么方向移动;
B、根据浓度商与平衡常数的大小关系判断平衡向什么方向移动;
C、根据△G=△H-T△S判断是否自发;
D、根据反应前后气体物质的量的变化判断熵的变化.
B、根据浓度商与平衡常数的大小关系判断平衡向什么方向移动;
C、根据△G=△H-T△S判断是否自发;
D、根据反应前后气体物质的量的变化判断熵的变化.
解答:
解:A、因为B为固体,所以浓度商Qc=
,若
>K,则平衡向逆反应方向移动,故A错误;
B、因为B为固体,所以浓度商Qc=
,故B错误;
C、因为B为固体,则m+n<p,则m<p的大小关系,则△S>0,又a<0即△H<0,所以△G=△H-T△S<0,则正反应一定可以自发进行,故C正确;
D、因为B为固体,则m+n>p,无法判断m和p的大小关系,则△S就不确定,故D错误;
故选:C;
(
| ||
(
|
(
| ||
(
|
B、因为B为固体,所以浓度商Qc=
(
| ||
(
|
C、因为B为固体,则m+n<p,则m<p的大小关系,则△S>0,又a<0即△H<0,所以△G=△H-T△S<0,则正反应一定可以自发进行,故C正确;
D、因为B为固体,则m+n>p,无法判断m和p的大小关系,则△S就不确定,故D错误;
故选:C;
点评:本题考查化学平衡移动的判断,熵变和是否自发的判断,题目难度不大,注意判断的方法即可解题.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
某基态原子的N能层上有2个电子,他对应的二价阳离子所含质子数不可能为( )
| A、22 | B、25 | C、26 | D、29 |
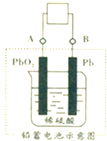 电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-
| 放电 |
| 充电 |
| A、放电时电极 PbO2 发生氧化反应 |
| B、放电时电子流向由A到B |
| C、工作时蓄电池里电解质溶液的pH不变 |
| D、放电时正极反应是PbO2+2e-+4H++SO42-═PbSO4+2H2O |
化学基本概念的理解和把握是学好化学的关键.下列说法正确的是( )
| A、燃烧热指的是可燃物完全燃烧生成稳定的氧化物所放出的热量 |
| B、勒夏特列原理指的是,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动 |
| C、盐溶液不一定显中性,不显中性的盐都会促进水的电离 |
| D、电镀是利用原电池原理在某些金属表面镀上一薄层其他金属或合金的方法 |