题目内容
研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)已知石墨的标准燃烧热为y kJ?mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量.则石墨与氧气反应生成CO的热化学方程式为:
.
(2)高温时,用CO还原MgSO4可制备高纯MgO.
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是: .
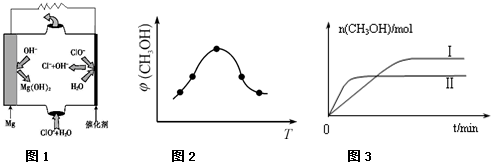
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1所示,该电池反应的离子方程式为: .
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的△H (填“>”“<”或“=”)0.
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠKⅡ(填“>”“<”或“=”).
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为 .
(1)已知石墨的标准燃烧热为y kJ?mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量.则石墨与氧气反应生成CO的热化学方程式为:
(2)高温时,用CO还原MgSO4可制备高纯MgO.
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1所示,该电池反应的离子方程式为:

(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的△H
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠKⅡ(填“>”“<”或“=”).
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
考点:化学平衡的计算,化学方程式的书写
专题:
分析:(1)1.2g石墨的物质的量为n(C)=
=0.1mol,1.68L氧气的物质的量为n(O2)=
=0.07mol,生成物为CO和CO2的混合物,设生成CO的物质的量为nmol,由C元素守恒得CO2的物质的量为(0.1-n)mol,根据关系式nC~n
O2~nCO,(0.1-n)O2~(0.1-n)CO2,则
n+(0.1-n)=0.075,n=0.05,所以反应后生成0.05molCO,0.05molCO2,根据反应放出的总热量x kJ和1mol石墨完全燃烧放出y kJ(y>0)的热量,可计算出生成0.05molCO放出的热量,进而求出反应的热化学方程式;
(2)①根据题目信息写出生成物,根据质量守恒配平;
②由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2;
(3)①根据到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;
②根据先拐先平数值大原则,由图1可知,温度T1<T2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,据此判断反应热,K1与K2关系;
③根据平衡三部曲求出甲中平衡时各气体的物质的量,然后根据平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行来判断范围.
| 1.2g |
| 12g/mol |
| 1.68L |
| 22.4L/mol |
| 1 |
| 2 |
| 1 |
| 2 |
(2)①根据题目信息写出生成物,根据质量守恒配平;
②由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2;
(3)①根据到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;
②根据先拐先平数值大原则,由图1可知,温度T1<T2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,据此判断反应热,K1与K2关系;
③根据平衡三部曲求出甲中平衡时各气体的物质的量,然后根据平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行来判断范围.
解答:
解:(1)1.2g石墨的物质的量为n(C)=
=0.1mol,1.68L氧气的物质的量为n(O2)=
=0.07mol,生成物为CO和CO2的混合物,设生成CO的物质的量为nmol,由C元素守恒得CO2的物质的量为(0.1-n)mol,根据关系式nC~n
O2~nCO,(0.1-n)O2~(0.1-n)CO2,则
n+(0.1-n)=0.075,n=0.05,所以反应后生成0.05molCO,0.05molCO2,1mol石墨完全燃烧放出ykJ(y>0)的热量,所以生成0.05molCO2放出的热量为0.05yKJ,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量.则生成0.05molCO放出的热量为(x-0.05y)kJ,所以生成1molCO放出的热量为
kJ,即(20x-y)kJ,所以热化学方程式为:C(s)+
O2(g)=CO(g)△H=-(20x-y)kJ?mol-1,故答案为:C(s)+
O2(g)=CO(g)△H=-(20x-y)kJ?mol-1;
(2)①用CO还原MgSO4可得到MgO、CO2、SO2和SO3,方程式为CO+2MgSO4
2MgO+CO2+SO2+SO3,故答案为:CO+2MgSO4
2MgO+CO2+SO2+SO3;
②由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2,该电池反应的总反应方程式为Mg+ClO-+H2O=Cl-+Mg(OH)2,故答案为:Mg+ClO-+H2O=Cl-+Mg(OH)2;
(3)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H<0.故答案为:<;
②由图1可知,温度T1<T2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应,则△H<0,升高温度,平衡向逆反应移动,所以K1>K2,
故答案为:>;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始:1 3 0 0
平衡:1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即(4-2x)/4=0.8
解得x=0.4mol
依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<n(c)≤1,故答案为:0.4<n(c)≤1.
| 1.2g |
| 12g/mol |
| 1.68L |
| 22.4L/mol |
| 1 |
| 2 |
| 1 |
| 2 |
| x-0.05y |
| 0.05 |
| 1 |
| 2 |
| 1 |
| 2 |
(2)①用CO还原MgSO4可得到MgO、CO2、SO2和SO3,方程式为CO+2MgSO4
| ||
| ||
②由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2,该电池反应的总反应方程式为Mg+ClO-+H2O=Cl-+Mg(OH)2,故答案为:Mg+ClO-+H2O=Cl-+Mg(OH)2;
(3)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H<0.故答案为:<;
②由图1可知,温度T1<T2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应,则△H<0,升高温度,平衡向逆反应移动,所以K1>K2,
故答案为:>;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始:1 3 0 0
平衡:1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即(4-2x)/4=0.8
解得x=0.4mol
依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<n(c)≤1,故答案为:0.4<n(c)≤1.
点评:本题考查涉及知识点较多,涉及平衡常数的计算、平衡状态的判断以及外界条件对平衡移动的影响等问题,题目难度中等,本题注意把握计算方法以及平衡常数的运用.

练习册系列答案
相关题目
下列物质常温下为液态的是( )
| A、苯 | B、乙炔 | C、乙烯 | D、甲烷 |
下列说法中,正确的是( )
| A、SO2能使品红溶液和酸性KMnO4溶液褪色,都是因为SO2具有漂白性 |
| B、硅单质是制造光电池、CPU和光导纤维的主要原料 |
| C、质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,产生气体的质量相同 |
| D、FeSO4溶液存放在加有少量铁粉的试剂瓶中 |
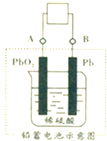 电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-
| 放电 |
| 充电 |
| A、放电时电极 PbO2 发生氧化反应 |
| B、放电时电子流向由A到B |
| C、工作时蓄电池里电解质溶液的pH不变 |
| D、放电时正极反应是PbO2+2e-+4H++SO42-═PbSO4+2H2O |

