题目内容
若NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、1 mol NH3与1 mol OH-所含的质子数均为10NA |
| B、标准状况下,22.4L CHCl3中含C-H键数目为NA |
| C、1mol Fe与足量的稀HNO3反应时,转移3NA个电子 |
| D、常温下,pH=13的NaOH溶液中含OH-数目为0.1NA |
考点:阿伏加德罗常数
专题:
分析:A.1个氢氧根离子含有9个质子;
B.气体摩尔体积适用对象为气体;
C.铁与足量稀硝酸反应生成硝酸铁;
D.溶液的体积未知.
B.气体摩尔体积适用对象为气体;
C.铁与足量稀硝酸反应生成硝酸铁;
D.溶液的体积未知.
解答:
解:A.1 mol NH3含有10NA个质子,1 mol OH-所含的质子数为9NA,故A错误;
B.标况下,CHCl3为液体,不能使用气体摩尔体积,故B错误;
C.1mol Fe与足量的稀HNO3反应生成1mol硝酸铁,转移3NA个电子,故C正确;
D.溶液的体积未知,无法计算NaOH溶液中含OH-数目,故D错误;
故选:C.
B.标况下,CHCl3为液体,不能使用气体摩尔体积,故B错误;
C.1mol Fe与足量的稀HNO3反应生成1mol硝酸铁,转移3NA个电子,故C正确;
D.溶液的体积未知,无法计算NaOH溶液中含OH-数目,故D错误;
故选:C.
点评:本题考查了阿伏伽德罗常的应用,明确气体摩尔体积的条件应用是解题关键,题目难度不大.

练习册系列答案
相关题目
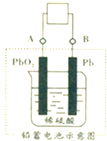 电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-
| 放电 |
| 充电 |
| A、放电时电极 PbO2 发生氧化反应 |
| B、放电时电子流向由A到B |
| C、工作时蓄电池里电解质溶液的pH不变 |
| D、放电时正极反应是PbO2+2e-+4H++SO42-═PbSO4+2H2O |
用0.1mol/LNaOH溶液滴定0.1mol/L盐酸溶液,如达到滴定终点时不慎多加了1滴NaOH溶液 (1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是( )
| A、10 | B、9 |
| C、11.5 | D、12.5 |
下列解释事实的离子方程式正确的是( )
| A、铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| B、向Ca(ClO)2溶液中通入过量CO2制取次氯酸:2ClO-+H2O+CO2=2HClO+CO32- |
| C、向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O |
| D、0.01 mol?L-1NH4Al(SO4)2溶液与0.02 mol?L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |




 是一种高分子材料,其单体的结构简式是
是一种高分子材料,其单体的结构简式是