��Ŀ����
5����1����25�������£���pH=11�İ�ˮϡ��100������Һ��pHΪ������ţ�D��A��9 B��13 C��11��13֮�� D��9��11֮��
��2��25��ʱ����0.1mol/L�İ�ˮ�м��������Ȼ�粒��壬�������ܽ�����ҺpH��С����Ҫԭ���ǣ�����ţ�C��
A��һˮ�ϰ�ˮ���Ȼ�立�����ѧ��Ӧ
B���Ȼ����Һˮ�������ԣ�������c��H+��
C���Ȼ������ˮ���������������ӣ�������һˮ�ϰ�ˮ�ĵ��룬ʹc��OH-����С
��3����25������ʱ��pH��Ϊ5��H2SO4��Һ��NH4Cl��Һ��H2SO4��Һ��c��H+��•c��OH-��=10-14 mol2•L-2��NH4Cl��Һ����ˮ�������c��H+����10-5mol•L-1��
��4�������£������0.1molNH4Cl��0.05molNaOHȫ������ˮ���γɻ����Һ����������ʧ����
��NH3•H2O��NH4+�������ӵ����ʵ���֮�͵���0.1mol��
��NH4+��H+�������ӵ����ʵ���֮�ͱ�OH-��0.05mol��
���� ��1��һˮ�ϰ���������ʣ���ˮϡ�ʹٽ�����룬��ˮϡ��100������Һ��c��OH-������ԭ����$\frac{1}{100}$����2����ˮ�м����Ȼ�泥�笠�����Ũ�����������һˮ�ϰ����룻
��3�����ӻ�����ֻ���¶��йأ�����Һ����Լ�Ũ���أ��Ȼ�林ٽ�ˮ���룬笠�����ˮ�����Һ�����ԣ��Ȼ����Һ��ˮ�������c��H+��=10-pH��
��4������0.1mol NH4Cl��0.05mol NaOHȫ������ˮ�γɻ����Һ����Һ�д���NH4+��NH3•H2O����������غ�͵���غ���
��� �⣺��1��һˮ�ϰ���������ʣ���ˮϡ�ʹٽ�����룬��ˮϡ��100������Һ��c��OH-������ԭ����$\frac{1}{100}$��������25�������£���pH=11�İ�ˮϡ��100������Һ��pH����9��С��11���ʴ�Ϊ��D��
��2����ˮ�м����Ȼ�泥�笠�����Ũ�����������һˮ�ϰ����룬������Һ��c��OH-����С����Һ��pH��С���ʴ�Ϊ��C��
��3�����ӻ�����ֻ���¶��йأ�����Һ����Լ�Ũ���أ�����c��H+��•c��OH-��=10-14mol2•L-2���Ȼ�林ٽ�ˮ���룬笠�����ˮ�����Һ�����ԣ��Ȼ����Һ��ˮ�������c��H+��=10-pH=10-5mol/L��
�ʴ�Ϊ��10-14��10-5��
��4���ٸ���Nԭ���غ��֪����Һ��NH3•H2O��NH4+�������ӵ����ʵ���֮�͵���0.1mol���ʴ�Ϊ��NH3•H2O��NH4+��
�ڸ��ݵ���غ�ʽc��NH4+��+c��H+��+c��Na+��=c��OH-��+c��Cl-������c��NH4+��+c��H+��-c��OH-��=c��Cl-��-c��Na+��=0.1mol-0.05mol���ʴ�Ϊ��NH4+��H+��
���� ���⿼��������ʵ��������ˮ�⣬Ϊ��Ƶ���㣬���ؿ���ѧ����������������������Һ�����ʼ��������ǽⱾ��ؼ���ע�����غ㼰�����غ����ȷ������ã�ע�⣺���ӻ�����ֻ���¶��йأ�Ϊ�״��㣮

| A�� | �٢� | B�� | �ۢ� | C�� | �ܢޢ� | D�� | �ڢޢ� |
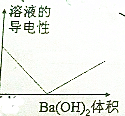
| A�� | �����£���ϡ��ˮ��μ���ϡ�����У�����ҺpH=7ʱ��c��SO42-����c��NH4+�� | |
| B�� | �����£�pH=3��������ˮϡ�ͺ���ҺpH��С | |
| C�� | �����£�pH=11��NaOH��Һ��pH=3�Ĵ�����Һ�������ϣ�����ʯ����Һ�ʺ�ɫ | |
| D�� | ��0.1mol/L�İ�ˮ�м�����������粒��壬����Һ��$\frac{c��O{H}^{-}��}{c��N{H}_{3}•{H}_{2}O��}$���� |
| �� | HF | Ka=6.8��10-4 mol•L-1 |
| �� | CH3COOH | Ka=1.7��10-5 mol•L-1 |
| �� | HCN | Ka=6.2��10-10 mol•L-1 |
| �� | H2CO3 | Ka1=4.4��10-7mol•L-1 Ka2=4.7��10-11 mol•L-1 |
��2��������0.1mol•L-1��CH3COOH��Һ�ڼ�ˮϡ�����У����б���ʽ������һ����С����D��
A��c��OH-��/c��H+�� B��c��H+��•c��OH-��
C�� $\frac{c��C{H}_{3}CO{O}^{-}��•c��{H}^{+}��}{c��C{H}_{3}COOH��}$ D��c��H+��
E��c��H+��/c��CH3COOH��
��3�����г�����pH=2�������pH=2�Ĵ�����Һ�ң���ͬ�����£�ȡ������ļס���������Һ����ϡ��100����ϡ�ͺ����Һ����pH��С��ϵӦΪ��pH���ף���pH���ң� �� ���������������=������
��4�����г�����0.01mol/L�������0.01mol/L������Һ������ͬ�����£�ȡ������ı�����������Һ����ϡ��100����ϡ�ͺ����Һ����pH��С��ϵӦΪ��
pH������С��pH������ �� ����ڡ�����С�ڡ����ڡ�����
��5��д�����з�Ӧ�����ӷ���ʽ��
?CH3COOH+Na2CO3����������?2CH3COOH+CO32-=H2O+2CH3COO-+CO2��
?HCN+Na2CO3����������?HCN+CO32-=CN-+HCO3-
?NaCN+CO2����������?CN-+CO2+H2O=HCN+HCO3-
| A�� | ��������ˮ�����ķ�Ӧ | B�� | ��Ƭ������������Һ�ķ�Ӧ | ||
| C�� | ���������������̼�ķ�Ӧ | D�� | ̼������Һ��ϡ����ķ�Ӧ |