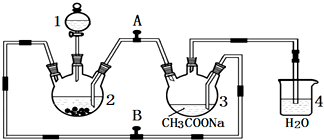
题目内容
17.向100mL 0.1mol/L H2SO4溶液中,逐滴加入0.1mol/L Ba(OH)2溶液过量,下列图象正确的是( )| A. | 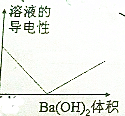 | B. | 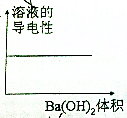 | ||
| C. | 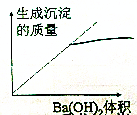 | D. | 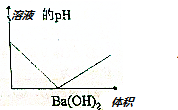 |
分析 向H2SO4溶液中,逐滴加入Ba(OH)2溶液过量,发生反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,随Ba(OH)2溶液加入,溶液中离子浓度减低,导电减弱,恰好反应时,导电性最差几乎为0,再加入过量的氢氧化钡溶液,溶液中离子浓度增大,溶液导电性又增大.随反应进行,生成硫酸钡的质量增大,硫酸完全反应时,沉淀量达最大值,再加入氢氧化钡溶液在,沉淀不变;随反应进行,氢离子浓度减小,酸性减弱,碱性增强.
解答 解:A.向H2SO4溶液中,逐滴加入Ba(OH)2溶液过量,发生反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,随Ba(OH)2溶液加入,溶液中离子浓度减低,导电减弱,恰好反应时,导电性最差几乎为0,再加入过量的氢氧化钡溶液,溶液中离子浓度增大,溶液导电性又增大,故A正确;
B.由A中分析可知,溶液导电性先减小后增大,故B错误;
C.随反应进行,生成硫酸钡的质量增大,硫酸完全反应时,沉淀量达最大值,再加入氢氧化钡溶液在,沉淀不变,故C错误;
D.随反应进行,氢离子浓度减小,酸性减弱,碱性增强,溶液pH增大,故D错误.
故选:A.
点评 本题考查电解质溶液导电性、溶液pH判断等,注意溶液导电能力与溶液中离子的浓度及离子所带电荷有关.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
12. 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(3)物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,pH由大到小的顺序是a>b>d>c(填编号).
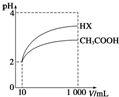
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+
),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(3)物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,pH由大到小的顺序是a>b>d>c(填编号).
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+
),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
2.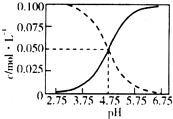 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )| A. | 25℃时,CH3COOH的电离常数K的值5×10-2.75 | |
| B. | 随pH增大,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| C. | pH=4的溶液中,c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | pH=5的溶液中,c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol•L-1 |
9.根据如表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | B元素不能形成共价化合物 | |
| B. | 离子半径大小A+>D2- | |
| C. | A和E形成的化合物中只可能含离子键 | |
| D. | B和E的化合物不能溶于氨水 |
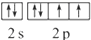 ,该元素的符号是O;
,该元素的符号是O;