题目内容
13.下列关于电解质溶液的叙述正确的是( )| A. | 室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | |
| B. | 室温下,pH=3的氢氟酸加水稀释后,溶液pH减小 | |
| C. | 室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
分析 A.根据电荷守恒判断;
B.加水稀释,溶液的体积增大,溶液中氢离子浓度减小;
C.醋酸为弱电解质,两溶液混合后醋酸过量,溶液显示酸性;
D.溶液中铵根离子浓度增大,抑制了一水合氨的电离.
解答 解A.混合溶液呈中性,所以c(H+)=c(OH-),根据电荷守恒得c(NH4+)+c(H+)=c(OH-)+2c(SO42-),所以c(NH4+)>c(SO42-),故A错误;
B.室温下,pH=3的氢氟酸加水稀释后,溶液的体积增大,溶液中氢离子浓度减小,溶液pH增大,故B错误;
C.pH=11的NaOH溶液的浓度为0.001mol/L,pH=3的醋酸溶液中醋酸的浓度远远大于0.001mol/L,所以两溶液等体积混合后醋酸过量,溶液显示酸性,滴入石蕊溶液呈红色,故C正确;
D.向0.1mol/L的氨水中加入少量硫酸铵固体,溶液中铵根离子浓度增大,抑制了一水合氨的电离,则一水合氨的浓度增大,氢氧根离子的浓度减小,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小,故D错误.
故选C.
点评 本题考查看酸碱混合定性判断、溶液酸碱性、溶液中离子浓度大小判断,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确溶液中离子浓度大小比较的方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下列叙述正确的是( )
| A. | 升高反应的温度,会使反应物的活化能迅速降低 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 推广使用太阳能、风能等能源,有利于缓解温室效应 |
2.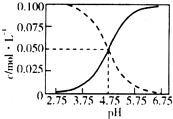 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )| A. | 25℃时,CH3COOH的电离常数K的值5×10-2.75 | |
| B. | 随pH增大,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| C. | pH=4的溶液中,c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | pH=5的溶液中,c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol•L-1 |
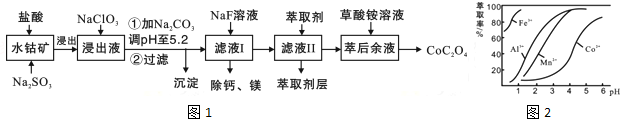
3.一种利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图1
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将Co3+、Fe3+还原.
(2)制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为6.72(标准状况).
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B(填选项序号).
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
(5)工业上用氨水吸收废气中的SO2.已知NH3•H2O的电离平衡常数K=1.8×10-5mol•L,H2SO3的电离平衡常数K1=1.2×10-2mol•L-4,K2=1.3×10-8mol•L-1.在通入废气的过程中:
①当恰好形成正盐时,溶液中离子浓度的大小关系为c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
②当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为HSO3-+OH-=SO32-+H2O.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为6.72(标准状况).
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B(填选项序号).
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
(5)工业上用氨水吸收废气中的SO2.已知NH3•H2O的电离平衡常数K=1.8×10-5mol•L,H2SO3的电离平衡常数K1=1.2×10-2mol•L-4,K2=1.3×10-8mol•L-1.在通入废气的过程中:
①当恰好形成正盐时,溶液中离子浓度的大小关系为c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
②当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为HSO3-+OH-=SO32-+H2O.