题目内容
16.配制480mL 0.5mol•L-1的NaOH溶液,试回答下列问题:(1)选择仪器:完成本实验所必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管等.
(2)计算、称量:需称量NaOH固体的质量为10.0 g.
(3)溶解、冷却.
(4)转移、洗涤.洗涤烧杯2~3次是为了保证溶质全部转移至容量瓶中.
(5)定容、摇匀.定容的具体操作是向容量瓶中加入蒸馏水至距刻度线1 cm~2 cm时,改用胶头滴管滴加蒸馏水至液体的凹液面最低处和刻度线相切.
(6)本实验中需要使用玻璃棒,作用是搅拌、引流.
(7)不规范的实验操作会导致实验结果的误差,下列使所配溶液的物质的量浓度偏高的是CD,偏低的是BE(填字母序号)
A.容量瓶洗净后未烘干;
B.在溶解过程中有少量液体溅出烧杯外
C.定容时俯视刻度线;
D.将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容
E.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线.
分析 (1)根据配制一定物质的量浓度的溶液步骤选用仪器,然后判断还缺少的仪器;
(2)实验室没有480mL的容量瓶,需要选用500mL的容量瓶,根据m=nM计算出500mL 0.5mol/L的氢氧化钠溶液中含有氢氧化钠的质量;
(3)在小烧杯中溶解,用玻璃棒加速溶解,冷却到室温;
(4)为保证小烧杯、玻璃棒上粘有的溶质全部转移到容量瓶中,需洗涤;
(5)先直接加水,当距刻度线1 cm~2 cm时,改用胶头滴管滴加蒸馏水至液体的凹液面最低处和刻度线相切;
(6)配制过程中,溶解氢氧化钠固体需要使用玻璃棒搅拌,转移溶液时需要使用玻璃棒引流;
(7)依据C=$\frac{n}{V}$分析,凡是使n偏小或者V偏大的操作,都会使溶液的浓度偏小,反之,浓度偏大.
解答 解:(1)没有规格为480mL的容量瓶,配制时需要选用500mL的容量瓶,实际上配制的是500mL 0.5mol/L的氢氧化钠溶液,配制步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,需要使用的仪器有:托盘天平、玻璃棒、烧杯、药匙、500mL容量瓶、胶头滴管等,还缺少的玻璃仪器为:500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶;胶头滴管;
(2)配制500mL 0.5mol/L的氢氧化钠溶液,需要氢氧化钠的质量为:m(NaOH)=40g/mol×0.5mol/L×0.5L=10.0g,
故答案为:10.0;
(4)在进行溶解操作时,小烧杯、玻璃棒上粘有溶质NaOH,为保证溶质全部转移至容量瓶中,需洗涤,
故答案为:保证溶质全部转移至容量瓶中;
(5)定容时,先直接向容量瓶中加水,待水位距刻度线1 cm~2 cm时,改用胶头滴管滴加蒸馏水至液体的凹液面最低处和刻度线相切,
故答案为:向容量瓶中加入蒸馏水至距刻度线1 cm~2 cm时,改用胶头滴管滴加蒸馏水至液体的凹液面最低处和刻度线相切;
(6)配制过程中,溶解氢氧化钠固体时,需要使用玻璃棒搅拌,加速氢氧化钠固体的溶解;转移溶液时,为了避免溶液流到容量瓶以外,应该使用玻璃棒引流,
故答案为:搅拌,引流;
(7)A.容量瓶洗净后未烘干,配制过程中需要滴加蒸馏水定容,故此无影响;
B.在溶解过程中有少量液体溅出烧杯外,溅出的液体中含有溶质,所以配制的溶液浓度偏低;
C.定容时俯视刻度线,溶液体积偏小,浓度偏高;
D.将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容,液体存在热胀冷缩,未冷却到室温就注入容量瓶定容,溶液体积偏小,浓度偏高;
E.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线,溶液的体积偏大,浓度偏低.
故答案为:CD;BE.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,题目难度不大,试题培养了学生的分析能力及化学检验能力.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案| A. | 最高价氧化物的水化物的碱性:Z>Y | B. | 离子的还原性:M>X | ||
| C. | 电子层数:Y<M | D. | 离子半径:Y<Z |
| 编号 | Cu | Zn | S |
| 1 | 10.3% | 5.0% | 1.2% |
| 2 | 11.5% | 4.9% | 1.8% |
| 3 | 12.4% | 10.3% | 0.9% |
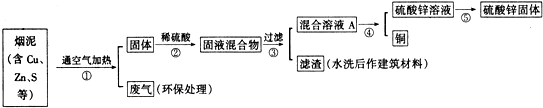
(1)写出步骤①②中含铜元素的物质发生反应的化学方程式:2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO、CuO+H2SO4=CuSO4+H2O.
(2)写出本方案中处理废气的方法(用化学方程式表示):2NaOH+SO2=Na2SO3+H2O.
(3)步骤⑤中所用的操作方法是:蒸发结晶(或蒸发、浓缩、结晶).
(4)在步骤④中,可选用试剂Zn从混合溶液A中得到铜.
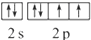 ,该元素的符号是O;
,该元素的符号是O;