题目内容
15.用NA表示阿伏加德罗常数,下列说法中正确的有( )| A. | 56克亚铁离子得到2NA个电子被还原成单质 | |
| B. | 1L 1mol/L的KCl溶液中含Cl-的物质的量为NA | |
| C. | 在25℃、1.01×105Pa的条件下,2.24LCO2中含有的原子数大于0.3NA | |
| D. | 0.1mol/L的氯化钡溶液中氯离子的数目是0.2NA |
分析 A.质量转化为物质的量,结合1个亚铁离子得到2个电子被还原为单质;
B.依据n=CV计算氯化钾的物质的量,结合1mol氯化钾含有1mol氯离子解答;
C.在25℃、1.01×105Pa的条件下,Vm>22.4L/mol;
D.溶液体积未知.
解答 解:A.56克亚铁离子物质的量为$\frac{56g}{56g/mol}$=1mol,得到2NA个电子被还原成单质,故A正确;
B.1L 1mol/L的KCl溶液中含Cl-的物质的量=1L×1mol/L×1=1mol,故B错误;
C.在25℃、1.01×105Pa的条件下,Vm>22.4L/mol,2.24LCO2中含有的原子数小于0.3NA,故C错误;
D.溶液体积未知,无法计算微粒个数,故D错误;
故选:A.
点评 本题考查了阿伏加德罗常数的使用,掌握以物质的量为核心的有关计算公式是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.

练习册系列答案
相关题目
5.日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
| A. | 铜片上出现铜绿[Cu2(OH)2CO3] | B. | 铁制菜刀生锈 | ||
| C. | 铝锅表面生成致密的氧化膜 | D. | 用醋清理水垢 |
3.原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征,下列各对粒子中,空间结构相似的是( )
①CS2与NO2
②CO2与N2O
③SO2与O3
④PCl3与BF3.
①CS2与NO2
②CO2与N2O
③SO2与O3
④PCl3与BF3.
| A. | ①②③ | B. | ③④ | C. | ②③④ | D. | ②③ |
20.已知X、Y、Z三种元素的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是( )
| A. | Y和Z可以组成一种Y和Z的质量比为7:8的化合物 | |
| B. | X、Y、Z组成的盐中既含离子键又含共价键 | |
| C. | X和Z可以组成原子个数比分别为1:1和2:1,常温下为液态的两种化合物 | |
| D. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒仅有2种 |
4.X、Y、Z、W分别为短周期主族元素,原子序数依次增加,Y、Z为同周期相邻的元素,且四种元素分布在所有短周期中.四种元素原子最外层电子数之和为16,且W为金属元素.下列有关叙述正确的是( )
| A. | 常见单质的沸点:X<Y<W | B. | 简单氢化物的热稳定性:Y>Z | ||
| C. | 简单离子的半径:W>Y>Z | D. | 四种元素只能形成两种离子化合物 |
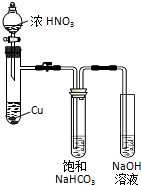 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应: