题目内容
4.X、Y、Z、W分别为短周期主族元素,原子序数依次增加,Y、Z为同周期相邻的元素,且四种元素分布在所有短周期中.四种元素原子最外层电子数之和为16,且W为金属元素.下列有关叙述正确的是( )| A. | 常见单质的沸点:X<Y<W | B. | 简单氢化物的热稳定性:Y>Z | ||
| C. | 简单离子的半径:W>Y>Z | D. | 四种元素只能形成两种离子化合物 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,四种元素分布在所有短周期中,则X为H元素;Y、Z为同周期相邻的元素,且W为金属元素,结合原子序数,可知Y、Z处于第二周期,W处于第三周期,四种元素原子最外层电子数之和为16,Y、Z、W三元素原子最外层电子数之和为16-1=15,Y、Z、W原子最外层电子数只能分别为6、7、2,故Y为O元素、Z为F元素、W为Mg,据此解答.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,四种元素分布在所有短周期中,则X为H元素;Y、Z为同周期相邻的元素,且W为金属元素,结合原子序数,可知Y、Z处于第二周期,W处于第三周期,四种元素原子最外层电子数之和为16,Y、Z、W三元素原子最外层电子数之和为16-1=15,Y、Z、W原子最外层电子数只能分别为6、7、2,故Y为O元素、Z为F元素、W为Mg.
A.常温下,Mg为固体,氢气、氧气为气体,故Mg的沸点最高,氢气、氧气均为分子晶体,氧气分子相对分子质量大,氧气沸点高于氢气的,故沸点:氢气<氧气<Mg,故A正确;
B.非金属性Z(F)>Y(O),故氢化物稳定性:Z>Y,故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->F->Al3+,故C错误;
D.四种元素形成离子化合物有:MgF2、MgO、MgH2等,故D错误;
故选:A.
点评 本题考查结构性质位置关系应用,侧重考查学生分析推理能力,注意对基础知识的理解掌握.

练习册系列答案
相关题目
15.用NA表示阿伏加德罗常数,下列说法中正确的有( )
| A. | 56克亚铁离子得到2NA个电子被还原成单质 | |
| B. | 1L 1mol/L的KCl溶液中含Cl-的物质的量为NA | |
| C. | 在25℃、1.01×105Pa的条件下,2.24LCO2中含有的原子数大于0.3NA | |
| D. | 0.1mol/L的氯化钡溶液中氯离子的数目是0.2NA |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- | |
| B. | 含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、I-、SO42- | |
| C. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- | |
| D. | c(Al3+)=0.5 mol•L-1的溶液中:Na+、K+、AlO2-、SO42- |
9.在下列变化过程中,被破坏的微粒间作用力正确的是( )
| A. | 冰融化一一共价键 | B. | 二氧化硅熔融--范德华力 | ||
| C. | 氢氧化钠溶于水--离子键、共价键 | D. | 硫酸氢钠溶于水--离子键、共价键 |
16.下列关于金属性质的叙述中正确的是( )
| A. | 钠与氧气反应时,产物只有一种 | |
| B. | 铝箔在空气中受热可以熔化且会发生剧烈燃烧 | |
| C. | 金属与非金属发生反应时,被氧化的一定是金属 | |
| D. | 铁丝不论在空气中还是纯氧中都不会燃烧 |
14.能源分类相关图如图所示,下列四组选项中,全部符合图中阴影部分的能源是( )
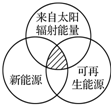

| A. | 沼气、煤炭、石油 | B. | 海洋能、地热能、核能 | ||
| C. | 天然气、水能、生物能 | D. | 风能、太阳能、潮汐能 |
 .
.