题目内容
7. 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:2NO2+2NaOH═NaNO2+NaNO3+H2O
2NO2+Na2CO3═NaNO2+NaNO3+CO2
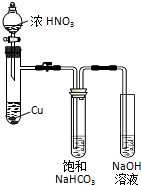
于是提出猜想,NO2和碱性的NaHCO3溶液也能发生类似反应.该小组利用如图所示装置,使NO2和NaHCO3溶液充分反应后,获得溶液X.
(1)Cu与浓硝酸反应的离子方程式是Cu+4H++2NO3-═3Cu2++2NO2↑+2H2O.
(2)该小组同学为了对猜想进行探究,进行如下讨论和实验.
①甲同学认为,可通过检验X中是否存在NO3-的方法验证猜想.但经讨论后认为不可行,你认为其原因是二氧化氮与水反应也能生成硝酸根.
②乙同学在X中加入少量K2Cr2O7溶液,结果溶液褪色,则证明X中含有NaNO2.根据以上信息,写出NO2与NaHCO3溶液反应的化学方程式2NO2+2NaHCO3═NaNO2+NaNO3+2CO2+H2O.
(3)已知在酸性条件下NO2-能将I-氧化为I2.你认为能否用KI淀粉溶液检验X中存在NaNO2:不能(填“能”或“不能”),原因是NaNO2和NaNO3在酸性条件下都能氧化碘离子生成碘单质.
(4)已知5NO2-+2MnO4-+6H+═5NO3-+2Mn2++3H2O.称取6.32g KMnO4固体,加蒸馏水和少量稀硫酸溶解,配成250mL溶液.移取20.00mL X于锥形瓶,用所配的酸性KMnO4溶液进行滴定,消耗25.00mL KMnO4溶液.滴点终点的现象是滴入最后一滴KMnO4溶液时,溶液由无色变为浅红色且保持30s不褪色,则X中NaNO2的浓度是0.5摩尔/升.
分析 (1)Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,根据电荷守恒和元素守恒书写离子反应方程式;
(2)①二氧化氮与水反应生成硝酸;
②NO2与NaHCO3溶液反应生成NaNO2,此时氮的化合价降低,根据氧化还原反应的原理可知,还应有硝酸根生成;
(3)X中既有NaNO2又有NaNO3,在酸性条件下都能氧化碘离子;
(4)用所配的酸性KMnO4溶液进行滴定NaNO2溶液,原来NaNO2溶液无色,滴点终点时溶液由无色变为浅红色,根据反应5NO2-+2MnO4-+6H+═5NO3-+2Mn2++3H2O,利用高锰酸钾的物质的量可计算出X中所含有的NaNO2的物质的量,进而确定NaNO2的浓度;
解答 解:(1)Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的离子反应方程式为Cu+4H++2NO3-═3Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-═3Cu2++2NO2↑+2H2O;
(2)①二氧化氮与水反应也能生成硝酸根,所以检验X中存在NO3-不能说明是NO2和NaHCO3溶液反应生成了硝酸根,
故答案为:二氧化氮与水反应也能生成硝酸根;
②NO2与NaHCO3溶液反应生成NaNO2,此时氮的化合价降低,根据氧化还原反应的原理可知,还应有硝酸根生成,所以NO2与NaHCO3溶液反应的化学方程式为2NO2+2NaHCO3═NaNO2+NaNO3+2CO2+H2O,
故答案为:2NO2+2NaHCO3═NaNO2+NaNO3+2CO2+H2O;
(3)X中既有NaNO2又有NaNO3,NaNO2和NaNO3在酸性条件下都能氧化碘离子生成碘单质,所以不能用KI淀粉溶液检验X中存在NaNO2,
故答案为:不能;NaNO2和NaNO3在酸性条件下都能氧化碘离子生成碘单质;
(4)用所配的酸性KMnO4溶液进行滴定NaNO2溶液,原来NaNO2溶液无色,滴点终点时溶液由无色变为浅红色,所以滴点终点的现象是滴入最后一滴KMnO4溶液时,溶液由无色变为浅红色且保持30s不褪色,高锰酸钾的物质的量为$\frac{6.32}{158}×\frac{25}{250}$mol=0.004mol,根据反应5NO2-+2MnO4-+6H+═5NO3-+2Mn2++3H2O,可知20.00mL X溶液中所含有的NaNO2的物质的量为0.004mol×$\frac{5}{2}$=0.01mol,所以NaNO2的浓度为$\frac{0.01mol}{0.02L}$=0.5mol/L,
故答案为:滴入最后一滴KMnO4溶液时,溶液由无色变为浅红色且保持30s不褪色;0.5.
点评 本题考查较为综合,以物质的制备实验为载体,综合考查实验的设计、物质的检验、氧化还原滴定等知识,注意根据物质的性质设计实验方案,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH33+H2O | |
| B. | CH2═CH2+HBr→CH3CH2Br | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 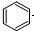 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$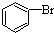 +HBr +HBr |
| A. | 56克亚铁离子得到2NA个电子被还原成单质 | |
| B. | 1L 1mol/L的KCl溶液中含Cl-的物质的量为NA | |
| C. | 在25℃、1.01×105Pa的条件下,2.24LCO2中含有的原子数大于0.3NA | |
| D. | 0.1mol/L的氯化钡溶液中氯离子的数目是0.2NA |
| A. | 能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- | |
| B. | 含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、I-、SO42- | |
| C. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- | |
| D. | c(Al3+)=0.5 mol•L-1的溶液中:Na+、K+、AlO2-、SO42- |
| A. | 钠与氧气反应时,产物只有一种 | |
| B. | 铝箔在空气中受热可以熔化且会发生剧烈燃烧 | |
| C. | 金属与非金属发生反应时,被氧化的一定是金属 | |
| D. | 铁丝不论在空气中还是纯氧中都不会燃烧 |
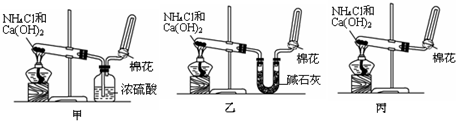
(1)装置:
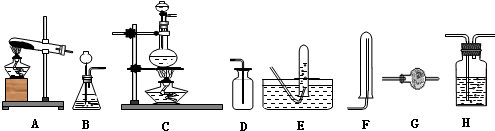
(2)试剂:a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液
e.碱石灰 f.品红溶液 g.湿润的红色石蕊试纸
| 制取气体 | 杂质气体 | 制取气体的发生装置 | 除去杂质气体的净化装置 | 收集装置 | 净化装置内 所用试剂 | 检验制得气体所用试剂 |
| NH3 | H2O(g) |
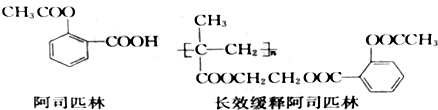
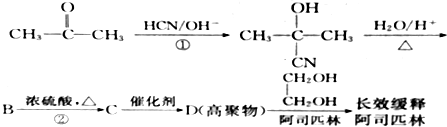
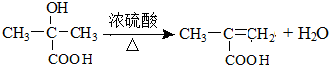
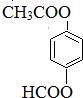 (只写一种)
(只写一种)