题目内容
 测某种含有少量氧化钠的过氧化钠试样的质量分数.
测某种含有少量氧化钠的过氧化钠试样的质量分数.方法一:利用下图装置测定混合物中Na2O2的质量分数,已知试样质量为1.560g、锥形瓶和水的质量为190.720g,每隔相同时间读得电子天平的数据如表:
| 读数次数 | 质量(g) | |
| 锥形瓶+水+试样 | 第1次 | 192.214 |
| 第2次 | 192.164 | |
| 第3次 | 192.028 | |
| 第4次 | 192.010 | |
| 第5次 | 192.010 |
(2)该试样中过氧化钠的质量分数为
不必作第6次读数的原因是
方法二:测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:

(3)操作Ⅱ的名称是
(4)需直接测定的物理量是
(5)测定过程中需要的仪器有电子天平、蒸发皿、酒精灯、还需要
(6)在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果
(填偏大、偏小或不变).
方法三:请从下图中选用适当仪器测定混合物中Na2O2的质量分数,要求操作简单.除待测试样外,限选试剂:CaCO3固体,6mol/L盐酸和蒸馏水
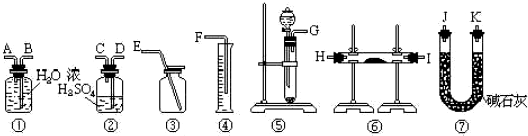
(7)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略)
考点:探究物质的组成或测量物质的含量,钠的重要化合物
专题:实验探究和数据处理题,几种重要的金属及其化合物
分析:方法一、(1)过氧化钠与水反应生成氢氧化钠与氧气;
(2)计算过氧化钠质量分数时,应用过氧化钠完全反应的数据,根据称量的锥形瓶+水+试样总质量变化计算生成氧气的质量,根据氧气的质量计算过氧化钠的质量;
由表中数据可知,第4、5次读数相等,锥形瓶内质量已达到恒重;
方法二、(3)由流程图可知,操作Ⅱ是从溶液中获得氯化钠晶体,应采取蒸发结晶;
(4)最终蒸发冷却结晶得到晶体为氯化钠,故应测定NaCl的质量;
(5)在烧杯内用盐酸溶解样品,并用玻璃棒搅拌,在蒸发皿中加热蒸发结晶,并用玻璃棒搅拌,用天平称量氯化钠的质量;
(6)转移溶液时,如溶液转移不完全,烧杯内壁放出少量氯化钠,测定氯化钠的质量偏小,样品中钠元素的质量分数偏低,故Na2O2质量分数偏大;
方法三、(7)氧化钠和过氧化钠均能和水反应;根据氧化钠和过氧化钠与水反应的区别:过氧化钠和水反应生成氢氧化钠溶液的同时,还会生成氧气,可以用排水量气法测定氧气的体积,进而确定过氧化钠的量及其百分含量;装置的组装顺序:固体混合物与水反应,用排水量气法测定氧气的体积;其中盛水的试剂瓶导管一定要短进长出,大气压强原理将水排出,量筒中水的体积就是生成氧气的体积.
(2)计算过氧化钠质量分数时,应用过氧化钠完全反应的数据,根据称量的锥形瓶+水+试样总质量变化计算生成氧气的质量,根据氧气的质量计算过氧化钠的质量;
由表中数据可知,第4、5次读数相等,锥形瓶内质量已达到恒重;
方法二、(3)由流程图可知,操作Ⅱ是从溶液中获得氯化钠晶体,应采取蒸发结晶;
(4)最终蒸发冷却结晶得到晶体为氯化钠,故应测定NaCl的质量;
(5)在烧杯内用盐酸溶解样品,并用玻璃棒搅拌,在蒸发皿中加热蒸发结晶,并用玻璃棒搅拌,用天平称量氯化钠的质量;
(6)转移溶液时,如溶液转移不完全,烧杯内壁放出少量氯化钠,测定氯化钠的质量偏小,样品中钠元素的质量分数偏低,故Na2O2质量分数偏大;
方法三、(7)氧化钠和过氧化钠均能和水反应;根据氧化钠和过氧化钠与水反应的区别:过氧化钠和水反应生成氢氧化钠溶液的同时,还会生成氧气,可以用排水量气法测定氧气的体积,进而确定过氧化钠的量及其百分含量;装置的组装顺序:固体混合物与水反应,用排水量气法测定氧气的体积;其中盛水的试剂瓶导管一定要短进长出,大气压强原理将水排出,量筒中水的体积就是生成氧气的体积.
解答:
解:方法一、(1)过氧化钠与水反应生成氢氧化钠与氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)计算过氧化钠质量分数时,应用过氧化钠完全反应的数据,根据称量的锥形瓶+水+试样总质量变化计算生成氧气的质量,根据氧气的质量计算过氧化钠的质量,试样质量、锥形瓶加水的质量为190.720g,试样质量为1.560g,称量至恒重质量为192.010g,反应反应生成氧气质量=192.280g-192.010g=0.27g,
2Na2O2+2H2O=4NaOH+O2↑,
2×78 32
m 0.270g
计算得到过氧化钠质量m=
g=0.4725g;
过氧化钠质量分数=
×100%=30.3%;
由表中数据可知,第4、5次读数相等,锥形瓶内质量已达到恒重,不需要作第6次读数,
故答案为:30.3%;第4、5次读数相等,锥形瓶内质量已达到恒重;
方法二、(3)由流程图可知,操作Ⅱ是从溶液中获得氯化钠晶体,应采取蒸发结晶,故答案为:蒸发;
(4)最终蒸发冷却结晶得到晶体为氯化钠,故应测定NaCl的质量,故答案为:NaCl的质量;
(5)在烧杯内用盐酸溶解样品,并用玻璃棒搅拌,在蒸发皿中加热蒸发结晶,并用玻璃棒搅拌,用天平称量氯化钠的质量,故答案为:烧杯;玻璃棒;
(6)转移溶液时,如溶液转移不完全,烧杯内壁放出少量氯化钠,测定氯化钠的质量偏小,样品中钠元素的质量分数偏低,由于过氧化钠中钠元素的质量分数小于氧化钠中钠元素质量分数,故Na2O2质量分数偏大,
故答案为:偏大;
方法三、(7)氧化钠和过氧化钠均能和水反应,方程式为:2Na2O2+2H2O=4NaOH+O2↑;Na2O+H2O=2NaOH,实验的原理是:过氧化钠和水反应生成氢氧化钠溶液的同时,还会生成氧气,但氧气中会有水蒸气,要用浓硫酸吸水,然后可以用排水量气法测定氧体的体积,进而确定过氧化钠的量及其百分含量,故可选择的装置为⑤②①④即可,用排水量气法测定氧体的体积时,其中盛水的试剂瓶导管一定要短进长出,大气压强原理将水排出,量筒中水的体积就是生成氧气的体积,故连接次序:(G)接(D)(C)(A)(B)接(F);
故答案为:(G)接(D)(C)(A)(B)接(F).
(2)计算过氧化钠质量分数时,应用过氧化钠完全反应的数据,根据称量的锥形瓶+水+试样总质量变化计算生成氧气的质量,根据氧气的质量计算过氧化钠的质量,试样质量、锥形瓶加水的质量为190.720g,试样质量为1.560g,称量至恒重质量为192.010g,反应反应生成氧气质量=192.280g-192.010g=0.27g,
2Na2O2+2H2O=4NaOH+O2↑,
2×78 32
m 0.270g
计算得到过氧化钠质量m=
| 2×78×0.270 |
| 32 |
过氧化钠质量分数=
| 0.4725g |
| 1.560g |
由表中数据可知,第4、5次读数相等,锥形瓶内质量已达到恒重,不需要作第6次读数,
故答案为:30.3%;第4、5次读数相等,锥形瓶内质量已达到恒重;
方法二、(3)由流程图可知,操作Ⅱ是从溶液中获得氯化钠晶体,应采取蒸发结晶,故答案为:蒸发;
(4)最终蒸发冷却结晶得到晶体为氯化钠,故应测定NaCl的质量,故答案为:NaCl的质量;
(5)在烧杯内用盐酸溶解样品,并用玻璃棒搅拌,在蒸发皿中加热蒸发结晶,并用玻璃棒搅拌,用天平称量氯化钠的质量,故答案为:烧杯;玻璃棒;
(6)转移溶液时,如溶液转移不完全,烧杯内壁放出少量氯化钠,测定氯化钠的质量偏小,样品中钠元素的质量分数偏低,由于过氧化钠中钠元素的质量分数小于氧化钠中钠元素质量分数,故Na2O2质量分数偏大,
故答案为:偏大;
方法三、(7)氧化钠和过氧化钠均能和水反应,方程式为:2Na2O2+2H2O=4NaOH+O2↑;Na2O+H2O=2NaOH,实验的原理是:过氧化钠和水反应生成氢氧化钠溶液的同时,还会生成氧气,但氧气中会有水蒸气,要用浓硫酸吸水,然后可以用排水量气法测定氧体的体积,进而确定过氧化钠的量及其百分含量,故可选择的装置为⑤②①④即可,用排水量气法测定氧体的体积时,其中盛水的试剂瓶导管一定要短进长出,大气压强原理将水排出,量筒中水的体积就是生成氧气的体积,故连接次序:(G)接(D)(C)(A)(B)接(F);
故答案为:(G)接(D)(C)(A)(B)接(F).
点评:本题考查物质含量测定、对实验方案的理解、物质分离提纯、误差分析等,主要考查实验基本技能与操作与测定原理,难度中等,是对学生综合能力的考查,难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
①元素原子的最外层电子数等于元素的最高化合价
②最外层一个电子的元素一定是金属元素,肯定在元素周期表的第IA族
③所有元素的原子最外层最多可容纳的电子数均为8
④第3周期元素随原子序数增大各非金属元素对应的氧化物的水化物酸性一定逐渐增强
⑤同主族元素随原子序数增大,其原子半径逐渐增大.
①元素原子的最外层电子数等于元素的最高化合价
②最外层一个电子的元素一定是金属元素,肯定在元素周期表的第IA族
③所有元素的原子最外层最多可容纳的电子数均为8
④第3周期元素随原子序数增大各非金属元素对应的氧化物的水化物酸性一定逐渐增强
⑤同主族元素随原子序数增大,其原子半径逐渐增大.
| A、①②③④⑤ | B、①②③ |
| C、④⑤ | D、⑤ |
足量Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr混合溶液中,在此过程中溶液的pH与Cl2用量的关系示意图是(溶液体积变化忽略不计,且不考虑Cl2与水反应)( )
A、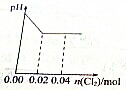 |
B、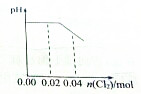 |
C、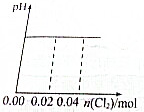 |
D、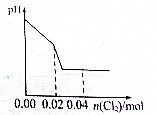 |
常温下,相同物质的量浓度的下列溶液中,pH最小的是( )
| A、KOH |
| B、NH3?H2O |
| C、HCl |
| D、H2SO4 |
将0.2mol?L-1的偏铝酸钠溶液和0.4mol?L-1的盐酸等体积混合,混合液中离子浓度由大到小的顺序是( )
| A、[Cl-]>[Al3+]>[Na+]>[H+]>[OH-] |
| B、[Cl-]>[Na+]>[Al3+]>[H+]>[OH-] |
| C、[Cl-]>[Al3+]>[Na+]>[OH-]>[H+] |
| D、[Na+]>[Cl-]>[Al3+]>[OH-]=[H+] |
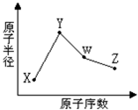 X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.