题目内容
15.“关爱生命,注意安全”.惨痛的天津爆炸触目惊心,火灾之后依然火势绵延不绝的原因之一是易燃物中含有电石.工业上常用电石(主要成分为CaC2,杂质为CaS等)与水反应生产乙炔气.(1)工业上合成CaC2主要采用氧热法.
已知:CaO(s)+3C(s)═CaC2(s)+CO(g)△H=+464.1kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO,为维持热平衡,每生产l molCaC2,转移电子的物质的量为10.4.
(2)已知2000℃时,合成碳化钙的过程中还可能涉及到如下反应
CaO(s)+C(s)═Ca(g)+CO(g) K1△H1=a KJ•mol-1
Ca(g)+2C(s)═CaC2(s) K2△H2=b KJ•mol-1
2CaO(s)+CaC2(s)═3Ca(g)+2CO(g) K3△H3=c KJ•mol-1
则K1=$\sqrt{{K}_{2}{K}_{3}}$ (用含K2、K3的代数式表示);c=(2a-b)(用含a、b的代数式表示).
(3)利用电石产生乙炔气的过程中产生的H2S气体制取H2,既廉价又环保.
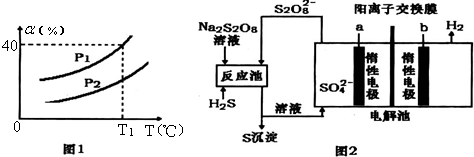
①利用硫化氢的热不稳定性制取氢气[2H2S(g)?S2(g)+2H2(g)].在体积为2L的恒容密闭容器中,H2S起始物质的量为2mol,达到平衡后H2S的转化率α随温度和压强变化如图l所示.据图计算T1℃、P1时平衡体系中H2的体积分数33.3%.由图知压强P1小于P2(填“大于”“小于”或“等于”),理由是相同温度下,压强增大,H2S分解反应逆向进行,所以P1小于P2.
②电化学法制取氢气的原理如图2,请写出反应池中发生反应的离子方程式H2S+S2O82-=S↓+2SO42-+2H+,惰性电极a上发生的电极反应式为2SO42--2e-=S2O82-.
分析 (1)若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO.则为了维持热平衡,所以每生产1molCaC2,则投料的量为:1molCaO、而投入碳的量为:3mol+$\frac{464.1kJ}{110.5kJ•mo{l}^{-1}}$=7.2mol,氧气的物质的量为$\frac{464.1kJ}{110.5kJ•mo{l}^{-1}}$×$\frac{1}{2}$=2.1mol,2.1mol氧气化合价降低8.4,1molCaC2化合物价降低2.0,共降低价数为10.4mol;
(2)由反应,①CaO(s)+C(s)?Ca(g)+CO(g)△H1=a kJ•mol-1;②Ca(g)+2C(s)?CaC2(s)△H2=b kJ•mol-1;根据盖斯定律,目标反应的反应热为:①×2-②得△H3=(2a-b)kJ•mol-1,K1=$\sqrt{{K}_{2}{K}_{3}}$;
(3)①根据三步法列出起始、变化和平衡时的物质的量,再根据气体的体积分数等于气体的物质的量分数计算;相同温度下,压强增大,H2S分解反应逆向进行,所以P1小于P2;
②反应池中H2S与S2O82-发生氧化还原反应;电解池中硫酸根离子失去电子,氢离子得到电子,以此来解答.
解答 解:(1)若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO.则为了维持热平衡,所以每生产1molCaC2,则投料的量为:1molCaO、而投入碳的量为:3mol+$\frac{464.1kJ}{110.5kJ•mo{l}^{-1}}$=7.2mol,氧气的物质的量为$\frac{464.1kJ}{110.5kJ•mo{l}^{-1}}$×$\frac{1}{2}$=2.1mol,2.1mol氧气化合价降低8.4,1molCaC2化合物价降低2.0,共降低价数为10.4mol,故答案为:10.4;
(2)由反应,①CaO(s)+C(s)?Ca(g)+CO(g)△H1=a kJ•mol-1;②Ca(g)+2C(s)?CaC2(s)△H2=b kJ•mol-1;根据盖斯定律,目标反应=①×2-②,K1=$\sqrt{{K}_{2}{K}_{3}}$;反应热c=(2a-b)kJ•mol-1,
故答案为:$\sqrt{{K}_{2}{K}_{3}}$;(2a-b);
(3)①H2S起始浓物质的量为2mol,测定H2S的转化率,T1时H2S的转化率为40%,则
H2S(g)?H2(g)+1/2S2(g)
开始 2 0 0
转化0.8 0.8 0.4
平衡1.2 0.8 0.4
根据气体的体积分数等于气体的物质的量分数,P1时平衡体系中H2的体积分数=$\frac{0.8}{1.2+0.8+0.4}$=33.3%;
相同温度下,压强增大,H2S分解反应逆向进行,所以P1小于P2;
故答案为:33.3%;小于;相同温度下,压强增大,H2S分解反应逆向进行,所以P1小于P2;
②反应池中H2S与S2O82-发生氧化还原反应,离子方程式为H2S+S2O82-=S↓+2SO42-+2H+;电解池中硫酸根离子失去电子生成S2O82-,2SO42--2e-=S2O82-,
故答案为:H2S+S2O82-=S↓+2SO42-+2H+;2SO42--2e-=S2O82-.
点评 本题考查学生化学平衡常数、盖斯定律、化学平衡移动的影响和化学方程式的书写及计算方面的知识,综合性强,难度较大.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | Na2SO4 | B. | KNO3 | C. | Ca(NO3)2 | D. | KIO3 |
| 选项 | X | Y | Z | M |
| A | Fe | FeCl2 | FeCl3 | Cl2 |
| B | C | CO | CO2 | O2 |
| C | CO2 | Na2CO3 | NaHCO3 | NaOH |
| D | AlO2- | Al(OH)3 | Al3+ | CO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Na+、K+、Cl?、NO3? | B. | K+、Na+、ClO?、SO42- | ||
| C. | Al3+、Cu2+、Cl?、S2- | D. | Na+、Fe2+、NO3-、Cl- |
X(含杂质)$→_{操作②}^{加入①}$X
| 选项 | X(括号中的物质为杂质) | ① | ② |
| A | 乙酸乙酯(乙醇) | 饱和碳酸钠溶液 | 萃取、分液 |
| B | BaSO4(BaSO3) | 稀硝酸 | 过滤 |
| C | NaCl(Na2CO3) | 盐酸 | 蒸发结晶 |
| D | 铜(铝) | 浓硫酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 红宝石、玛瑙、水晶、钻石等装饰品的主要成分都不相同 | |
| B. | 将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3 | |
| C. | 白磷、臭氧、碳-60、氩、水等物质都是由分子构成的,分子内都存在共价键 | |
| D. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 |
| A. |  图中滴加乙醇,试管中橙色溶液变为绿色,说明K2Cr2O4被还原成K2CrO4 | |
| B. |  图中,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好 | |
| C. |  图中,由试管中收集到的无色气体,证明铜与稀硝酸的反应产物是NO | |
| D. |  图中,试管中先出现白色沉淀、加Na2S后产生黑色沉淀,但不能验证AgCl的溶解度大于Ag2S |