题目内容
17.实验是进行科学研究的重要手段.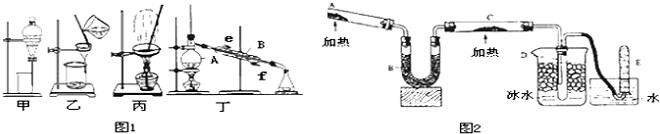
(1)如图1是中学化学中常用于混合物分离和提纯的装置,请回答问题:
①用CCl4可以从碘水中提取碘,该分离方法的名称为萃取,应选择下图中甲装置.
②从氯化钠溶液中得到氯化钠固体,应选择下图中的丙装置.
③装置丁中仪器B的名称是冷凝管,冷水进水方向:从f(填“e”或“f”)口进水.
④乙、丙中玻璃棒的作用分别是引流、搅拌.
(2)已知:加热条件下,氨和氧化铜可以发生反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O反应可以在如图2装置中进行.请回答下列问题:
①A中可采用实验室制法来制取氨,化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
②B中加入的干燥剂可选用a(填代号).a 碱石灰 b无水氯化钙 c 浓硫酸
③能证明氨与氧化铜反应的现象是:C中黑色粉末变红色;D中有无色液体生成.
分析 (1)①碘在四氯化碳中溶解度大于水,四氯化碳与水互不相溶;以及萃取实验选择装置;
②从氯化钠溶液中得到氯化钠固体,用降温结晶法分离二者;
③以及仪器的形状判断仪器的名称,依据冷凝管使用方法选择进出水位置;
④乙为过滤,丙为蒸发,玻璃棒的作用分别是引流、搅拌;
(2)①氯化铵与氢氧化钙反应生成氨气、氯化钙和水;
②氨气为碱性气体,应选择碱性干燥剂;
③氨气与氧化铜反应生成氮气和铜和水.
解答 解:(1)①碘在四氯化碳中溶解度大于水,四氯化碳与水互不相溶,分离方法为萃取,选择仪器为甲,故答案为:萃取;甲;
②从氯化钠溶液中得到氯化钠固体,用蒸发结晶法分离二者,用到的仪器为丙,故答案为:丙;
③装置图丁中仪器B的名称冷凝管,冷水进水方向,应下口进上口出,即f口进,故选:冷凝管;f;
④乙、丙中玻璃棒的作用分别是引流、搅拌,故答案为:引流、搅拌;
(2)①氯化铵与氢氧化钙反应生成氨气、氯化钙和水,方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②氨气为碱性气体,应选择碱性干燥剂,无水氯化钙、硫酸能够与氨气反应,不能干燥氨气,故选:a;
③氨气与氧化铜反应生成氮气和铜和水,现象为:C中黑色粉末变红色;D中有水生成,故答案为:黑色粉末变红色;有无色液体生成.
点评 本题考查混合物分离提纯及物质性质实验,为高考常见题型,侧重于学生的分析、实验能力的考查,把握物质的性质、混合物分离提纯、实验装置的作用为解答的关键,题目难度不大.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
7.用等体积的0.1mol•L-1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
| A. | 3:2:3 | B. | 3:1:2 | C. | 2:6:3 | D. | 1:1:1 |
8.用如图所示的装置进行实验,反应一段时间后断开K,向烧杯中加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )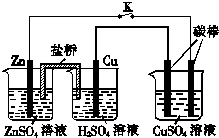

| A. | 铜棒为正极,其电极反应式为2H++2e-=H2↑ | |
| B. | 烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应中消耗锌的质量为6.5 g | |
| D. | 导线中通过电子的物质的量为0.1 mol |
5.元素X的原子,其M层与K层电子数相同;元素Y的原子,其M层上有7个电子.X和Y所形成的稳定化合物的相对分子质量为( )
| A. | 100 | B. | 95 | C. | 88 | D. | 80 |
12.优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2一乙烯吡啶(简写P2VP)和I2 的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为2Li+P2VP•nI2═P2VP•(n-1)I2+2LiI,则下列说法正确的是( )
| A. | 聚2一乙烯吡啶的复合物与有机物性质相似,因此聚2一乙烯吡啶的复合物不会导电 | |
| B. | 正极的反应为P2VP•nI2+2Li++2e-═P2VP•(n-1)I2+2LiI | |
| C. | 电池工作时,碘离子移向P2VP一极 | |
| D. | 该电池所产生的电压低,使用寿命比较短 |
2.在下列化学反应中,既有离子键、共价键断裂,又有离子键、共价键形成的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SO2+2H2S═3S+2H2O | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | NaOH+HCl═NaCl+H2O |
9.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,金属性最强的元素是K,最活泼的非金属元素是F;化学性质最不活泼的元素是Ar.
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3
(3)在③~⑦元素中,原子半径最大的是Na;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.与⑩元素同主族下一周期元素的一种化合物是食用盐中必须加入的,此化合物的化学式KIO3.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3
(3)在③~⑦元素中,原子半径最大的是Na;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.与⑩元素同主族下一周期元素的一种化合物是食用盐中必须加入的,此化合物的化学式KIO3.
6.物质的量浓度相同的下列溶液中,c(NH4+)最大的是( )
| A. | NH4Cl | B. | (NH4)2SO4 | C. | NH4HSO4 | D. | NH4HCO3 |
7.下列属于吸热反应的是( )
| A. | 铝与盐酸反应 | B. | Ba(OH)2?8H2O和NH4Cl固体反应 | ||
| C. | 盐酸和氢氧化钠的中和反应 | D. | 氢气的燃烧反应 |