题目内容
10.下列说法正确的是( )①实验室里需要480mL 2.0mol/L的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作
②用标准盐酸滴定NaOH溶液测其浓度时,酸式滴定管用蒸馏水洗涤后,没用标准盐酸润洗,直接装标准盐酸滴定,所测的碱液浓度偏低
③自发反应在恰当条件下才能实现
④钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH-
⑤电解饱和MgCl2溶液时,电极反应式为:2H2O+2Cl-═Cl2↑+H2↑+2OH-
⑥在海轮外壳连接锌块保护外壳不受腐蚀是采用牺牲阳极的阴极保护法
⑦长期使用硫酸铵,土壤酸性增强:草木灰与铵态氮肥不能混合施用.
| A. | ①②③⑤ | B. | ③⑤⑥⑦ | C. | ③④⑥⑦ | D. | ②③⑥⑦ |
分析 ①需要480mL 2.0mol/L的氢氧化钠溶液,应选择500mL容量瓶,实际配制500mL溶液,据此计算需要溶质的质量;
②如果不用标准液润洗滴定管会导致盐酸浓度降低,则使用盐酸体积偏大;
③有些自发进行的反应也需要反应条件;
④钢铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应;
⑤镁离子与氢氧根离子结合生成氢氧化镁沉淀;
⑥海轮外壳连接锌块,锌为负极;
⑦硫酸铵水解导致溶液呈酸性,草木灰与铵态氮肥相互促进水解.
解答 解:①要480mL 2.0mol/L的氢氧化钠溶液,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量为:0.5L×2.0mol/L×40g/mol=40.0g,故错误;
②如果不用标准液润洗滴定管会导致盐酸浓度降低,则使用盐酸体积偏大,依据c待测=$\frac{c标V标}{V待}$,测量结果偏高,故错误;
③些自发进行的反应也需要反应条件,才能进行,如氢气和氧气需要点燃反应,故正确;
④钢铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,故正确;
⑤电解饱和MgCl2溶液时,镁离子与氢氧根离子结合生成氢氧化镁,正确的电极反应式为:Mg2++2H2O+2Cl-=Cl2↑+H2↑+Mg(OH)2↓,故错误;
⑥海轮外壳连接锌块,锌为负极,保护外壳不受腐蚀,为牺牲阳极的阴极保护法,故正确;
⑦硫酸铵水解导致溶液呈酸性,草木灰与铵态氮肥相互促进水解,所以草木灰与铵态氮肥不能混合施用,故正确;
故选:C.
点评 本题考查较为综合,涉及金属的腐蚀与防护、盐的水解原理、中和滴定、配制一定浓度的溶液方法等知识,题目难度中等,明确金属腐蚀原理、中和滴定方法、盐的水解原理为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.某温度(t℃)时,水的离子积为Kω=1×10-13mol2L-2,则该温度与25℃相是( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 无法确定 |
1.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 8.4gNaHCO3晶体中含有0.1NA个CO32- | |
| B. | 常温常压下,32g臭氧所含的氧原子数为2NA | |
| C. | 0.1molFe与过量硝酸反应,转移电子数为0.2NA | |
| D. | 1molCH4与1molCl2在光照下反应,生成CH3Cl的分子数为NA |
18.以CO、H2、H2O和N2为原料,运用电化学原理合成氨的装置结构如图:下列有关说法不正确的是( )
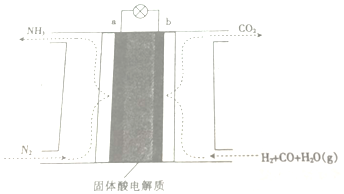

| A. | 放电时,b极表面H2与CO均被氧化 | |
| B. | 该电池工作时,H+由b极区迁移至a极区 | |
| C. | a极的电极反应为N2+6H++6e-=2NH3 | |
| D. | 工作一段时间后b极附近的PH增大 |
5.用CCl4 把碘从碘水中提取出来的方法是( )
| A. | 萃取 | B. | 过滤 | C. | 蒸发 | D. | 蒸馏 |
1.事实上,许多氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2═Na2SO4,2Na2O2+2SO3═2Na2SO4+O2,据此你认为下列反应方程式中不正确的是( )
| A. | 2Na2O2+2N2O5═4NaNO3+O2↑ | B. | Na2O2+2NO2═2NaNO2+O2 | ||
| C. | Na2O2+N2O4═2NaNO3 | D. | 2Na2O2+2Mn2O7═4NaMnO4+O2↑ |
 根据所学知识完成下列填空.
根据所学知识完成下列填空.