题目内容
4.胃酸的主要成分是( )| A. | 盐酸 | B. | 醋酸 | C. | 硫酸 | D. | 硝酸 |
分析 根据胃液中的胃酸是盐酸分析即可.
解答 解:胃酸的主要成分为盐酸,化学式为:HCl,故A符合,
故选A.
点评 本题考查胃酸的主要成分,掌握胃酸的主要成分为盐酸即可解答,题目较简单.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
14.我国古代在造纸、陶瓷、冶铸、火药等方面创造了灿烂的科技发明史.下列有关说法正确的是( )
| A. | 陶瓷的主要成分属于硅酸盐 | |
| B. | 青铜的熔点比组份金属铜和锡都高 | |
| C. | 利用SO2漂白纸张时只发生了物理变化 | |
| D. | 黑火药反应2KNO3+S+3C=K2S+N2↑+3CO2↑中,氧化剂只有KNO3 |
9.丁烷(分子式C4H10)广泛应用于家用液化石油气,也用于打火机中作燃料,下列关于丁烷叙述正确的是( )
| A. | 在常温常压下,C4H10是液体 | |
| B. | 丁烷有正丁烷与异丁烷两种同分异构体 | |
| C. | C4H10与C9H20互为同系物 | |
| D. | C4H10进行一氯取代后共生成两种沸点不同的产物 |
16.FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性.
I.实验室制备FeBr2
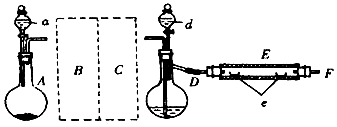
实验室用如图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两只耐高温的瓷皿,其中盛有细铁粉.实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在E管的一端有黄绿色鳞片状溴化亚铁.
请回答:
(1)仪器D的名称是蒸馏烧瓶.给D加热最好选择下列加热器中的b.

(2)若在A中烧瓶中盛固体CaCO3,a中盛6mol•L-1盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置所装的试剂是:B为盛有饱和NaHCO3溶液的洗气瓶,C为盛有浓H2SO4的洗气瓶.为防止污染空气,实验时应在F处连接盛有碱性溶液的尾气吸收装置.
(3)实验时,装置D和E的橡胶塞最好用铝箔包住,且连接D、E之间的橡胶管尽可能短的原因是Br2有腐蚀性,腐蚀橡胶塞.
(4)①E管反应前先通入一段时间CO2,其主要作用是排净容器里的空气;
②反应过程中要继续通入CO2,其主要作用是将Br2蒸气带入反应器中.
II.探究FeBr2的还原性
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究.
(5)现象i中溶液由浅绿色逐渐变黄.某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色.请设计实验证明现象i中溶液由浅绿色变黄色的原因是原因①还是原因②:取5mL上述黄色溶液于试管中,向该溶液中加入KSCN溶液,溶液变为红色,说明原因①对,否则不成立;取5mL上述黄色溶液于试管中,向其中滴加少量四氯化碳,震荡,若CCl4层呈橙红色,说明原因②对,否则不成立.
(6)若向上述FeBr2溶液中通入224mL Cl2(标准状况),则反应的离子方程式为2Cl2+2Br-+2Fe2+═2Fe3++4Cl-+Br2.
I.实验室制备FeBr2
实验室用如图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两只耐高温的瓷皿,其中盛有细铁粉.实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在E管的一端有黄绿色鳞片状溴化亚铁.

请回答:
(1)仪器D的名称是蒸馏烧瓶.给D加热最好选择下列加热器中的b.

(2)若在A中烧瓶中盛固体CaCO3,a中盛6mol•L-1盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置所装的试剂是:B为盛有饱和NaHCO3溶液的洗气瓶,C为盛有浓H2SO4的洗气瓶.为防止污染空气,实验时应在F处连接盛有碱性溶液的尾气吸收装置.
(3)实验时,装置D和E的橡胶塞最好用铝箔包住,且连接D、E之间的橡胶管尽可能短的原因是Br2有腐蚀性,腐蚀橡胶塞.
(4)①E管反应前先通入一段时间CO2,其主要作用是排净容器里的空气;
②反应过程中要继续通入CO2,其主要作用是将Br2蒸气带入反应器中.
II.探究FeBr2的还原性
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究.
| 操 作 | 现 象 |
| 取0.1mol/L的FeBr2溶液100mL,测溶液的pH | pH试纸变红(约为4) |
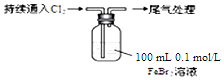 | ⅰ.开始通入100mLCl2(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
(6)若向上述FeBr2溶液中通入224mL Cl2(标准状况),则反应的离子方程式为2Cl2+2Br-+2Fe2+═2Fe3++4Cl-+Br2.
13.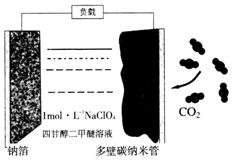 最近我国科学家发明“可充电钠-二氧化碳电池”(如图),放电时电池总反应为:4Na+3CO2═2Na2CO3+C.下列说法错误的是( )
最近我国科学家发明“可充电钠-二氧化碳电池”(如图),放电时电池总反应为:4Na+3CO2═2Na2CO3+C.下列说法错误的是( )
 最近我国科学家发明“可充电钠-二氧化碳电池”(如图),放电时电池总反应为:4Na+3CO2═2Na2CO3+C.下列说法错误的是( )
最近我国科学家发明“可充电钠-二氧化碳电池”(如图),放电时电池总反应为:4Na+3CO2═2Na2CO3+C.下列说法错误的是( )| A. | 电池工作温度可能在200℃以上 | |
| B. | 充电时,钠箔与外接电源的负极相连 | |
| C. | 该电池放电时吸收二氧化碳,充电时放出二氧化碳 | |
| D. | 放电时,正极的电极反应为:4Na++3CO2+4e-═2Na2CO3+C |
 根据所学知识完成下列填空.
根据所学知识完成下列填空.