题目内容
15.已知常温常压下在1L水中可溶解40L NO2,NO2能与NaOH溶液发生反应:2NaOH+2NO2═NaNO3+NaNO2+H2O.以下各种尾气吸收装置中,不适合吸收NO2气体的是( )| A. | 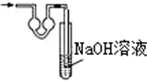 | B. | 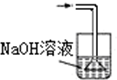 | C. | 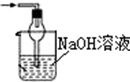 | D. | 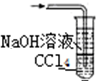 |
分析 由于常温常压下在1 L水中NO2可溶解40 L,即易溶于水,所以在吸收装置中需要防止倒吸,结合装置特征和放倒吸的原理分析判断.
解答 解:由于常温常压下在1 L水中NO2可溶解40 L,即易溶于水,所以在吸收装置中需要防止倒吸,
A.双球干燥管可以防止液体倒吸,故A不选;
B.导气管直接插入氢氧化钠溶液相同,不能防止倒吸,故B选;
C.球形干燥管有较大面积可以防止倒吸,故C不选;
D.二氧化氮不溶于四氯化碳,四氯化碳隔绝气体与NaOH溶液,可以防止倒吸,故D不选;
故选B.
点评 本题考查实验装置的应用及物质的性质,为高考常见题型和高频考点,侧重于学生的分析能力的考查,把握防倒吸装置为解答该题的关键,题目难度不大.

练习册系列答案
相关题目
3.催化技术可处理汽车尾气:2NO+2CO?2CO2+N2,某温度下在容积不变的密闭容器中通入NO 和CO,不同时间NO 和CO 的浓度如下表.下列说法中不正确的是( )
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2 s 内的平均反应速率υ(N2)=1.875×10-4 mol•L-1•s-1 | |
| B. | 在该温度下K=5 | |
| C. | 若将容积缩小为原来的一半,NO 转化率大于90% | |
| D. | 某时刻再充入0.1 mol NO,0.36 mol CO,重新达平衡后CO 浓度比原平衡大 |
10.纳米碳是“纳米材料”中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的分散系①是浊液 ②是胶体 ③静置后析出黑色碳粒 ④能产生丁达尔效应.判断正确的是( )
| A. | ①②④ | B. | ②③④ | C. | ②④ | D. | ①③④ |
7.元素的周期数等于( )
| A. | 电子层数 | B. | 原子量 | C. | 次外层电子数 | D. | 最外层电子数 |
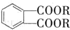 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示: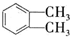 $→_{①光照}^{Cl_{2}}$[A]$\stackrel{②}{→}$[B]$→_{③△}^{Cu、O_{2}}$[C]$\stackrel{④}{→}$[D]$→_{⑤ROH/△}^{浓硫酸}$[DMP]
$→_{①光照}^{Cl_{2}}$[A]$\stackrel{②}{→}$[B]$→_{③△}^{Cu、O_{2}}$[C]$\stackrel{④}{→}$[D]$→_{⑤ROH/△}^{浓硫酸}$[DMP]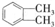 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.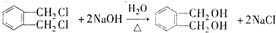 .
. .
.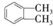 制备DMP的另一种途径:
制备DMP的另一种途径: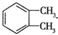 $→_{O_{2}①}^{催化剂、△}$
$→_{O_{2}①}^{催化剂、△}$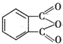 $→_{F②}^{适当条件}$[DMP]
$→_{F②}^{适当条件}$[DMP]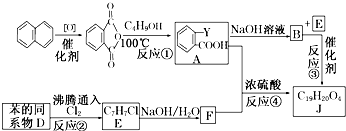
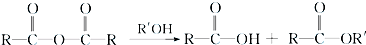
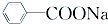 +RCl→
+RCl→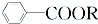 +NaCl;
+NaCl; .
. .
.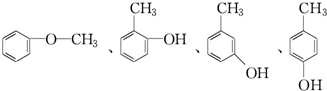 .
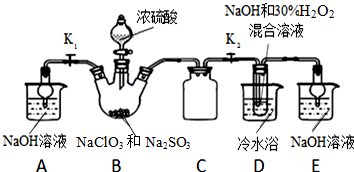
.
 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为: