题目内容
4.下列离子方程式中书写正确的一组是( )①向明矾溶液中加入Ba(OH)2溶液至A13+刚好完全沉淀:Al3++SO42-+3OH-+Ba2+=BaSO4↓+Al (OH)3↓
②氟气和水反应:2F2+2H2O=4H++4F-+O2
③向澄清石灰水中加入少量小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
④铜片投入稀HNO3溶液:Cu+NO3-+4H+=NO↑+2H2O+Cu2+
⑤钠与水反应:Na+2H2O=Na++OH-+H2↑
⑥碳酸钙放入盐酸中:CO32-+2H+=CO2↑+H2O
⑦向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+
⑧过量氯水与FeI2溶液作用:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-.
| A. | ③⑦ | B. | ①②③④ | C. | ①③④⑤ | D. | ①④⑥⑦⑧ |
分析 ①明矾溶液中n(Al3+):n(SO42-)=1:2,设硫酸铝为1mol,应加入1.5molBa(OH)2;
②氢氟酸为弱酸,应保留化学式;
③小苏打少量,反应生成碳酸钙、氢氧化钠和水;
④电荷不守恒;
⑤原子个数不守恒;
⑥碳酸钙为沉淀,应保留化学式;
⑦氯化铁水解生成氢氧化铁胶体;
⑧n(Fe2+):n(I-)=1:2.
解答 解:①明矾溶液中n(Al3+):n(SO42-)=1:2,设硫酸铝为1mol,应加入1.5molBa(OH)2,离子方程式应为2Al3++3SO42-+6OH-+3Ba2+═3BaSO4↓+2Al (OH)3↓,故①错误;
②氟气和水反应:2F2+2H2O=4HF+O2,故②错误;
③向澄清石灰水中加入少量小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O,离子方程式,故③正确;
④铜片投入稀HNO3溶液,离子方程式:3Cu+2NO3-+8H+=2NO↑+4H2O+3Cu2+,故④错误;
⑤钠与水反应,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故⑤错误;
⑥碳酸钙放入盐酸中,离子方程式:CaCO3+2H+=CO2↑+H2O+Ca2+,故⑥错误;
⑦向沸水中滴加FeCl3溶液制备Fe(OH)3胶体,离子方程式:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故⑦正确;
⑧n(Fe2+):n(I-)=1:2,应为2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl-,故⑧错误;
故选:A.
点评 本题考查了离子方程式的书写,明确物质的性质及发生反应是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
15.已知常温常压下在1L水中可溶解40L NO2,NO2能与NaOH溶液发生反应:2NaOH+2NO2═NaNO3+NaNO2+H2O.以下各种尾气吸收装置中,不适合吸收NO2气体的是( )
| A. | 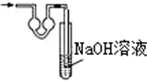 | B. | 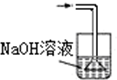 | C. | 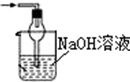 | D. | 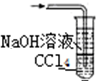 |
12.下列说法中正确的是( )
| A. | 通常元素的化合价与其原子的质量数有密切的关系 | |
| B. | 已知铱的一种核素是${\;}_{77}^{191}$Ir,则其核内的中子数是114 | |
| C. | ${\;}_{6}^{14}$C和${\;}_{7}^{17}$N的质量数相同,但质子数不同,所以互称为同位素 | |
| D. | 钾的原子结构示意图为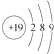 |
9.下列说法不正确的是( )
| A. | 石油分馏可获得汽油、煤油等矿物油,煤焦油干馏可获得苯、甲苯等有机物 | |
| B. | 使用“乙醇汽油”、“燃煤固硫”、“汽车尾气催化净化”等可提高空气质量 | |
| C. | 金刚石呈正四面体网状结构、C60呈笼状结构,这两种晶体中微粒间的作用力不完全相同 | |
| D. | 硬脂酸甘油酯在碱性条件下的水解属于皂化反应,乙酸乙酯在碱性条件下的水解不属于皂化反应 |
16.“当好东道主,喜迎G20”,目前杭州为迎接即将到来的G20峰会,大量引进新能源公交车,如图所示即为一辆正在充电的电动公交车.

已知钒电池是一种常用于纯电动公交车的电池,其原理是利用钒的不同价态之间的转化,例如某种电池的充电原理可表示为2H++V2++VO2+═2V3++H2O,则下列说法不正确的是( )

已知钒电池是一种常用于纯电动公交车的电池,其原理是利用钒的不同价态之间的转化,例如某种电池的充电原理可表示为2H++V2++VO2+═2V3++H2O,则下列说法不正确的是( )
| A. | 阴极反应可表示为 2H++VO2++e-═V3++H2O | |
| B. | 阳极反应可表示为 V2+-e-═V3+ | |
| C. | 若阴极电解液体积为1L,电解前pH=1,当测得V3+的物质的量浓度为0.045mol/L时,pH变为2(不考虑反应过程中体积变化) | |
| D. | 放电过程种负极反应可表示为V3++2OH--e-═VO2++H2O |
13.在KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O反应中,氧化剂与还原剂物质的量之比为( )
| A. | 1:6 | B. | 6:1 | C. | 1:5 | D. | 1:1 |
14.短周期主族元素X、Y、Z、W、M的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,z的单质能溶于w的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法不正确的是( )
| A. | 元素W的气态氢化物与M的单质可发生置换反应 | |
| B. | 离子半径的大小顺序为W>M>Z>X>Y | |
| C. | 元素Z、M的单质在一定条件下均能和强碱溶液反应 | |
| D. | 元素X与Y可以形成5种以上的化合物 |
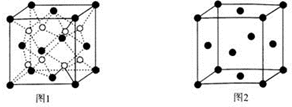
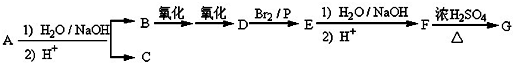

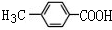 .
.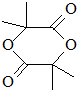 .
.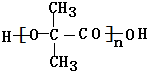 +(n-1)H2O,该反应属于缩聚反应(填反应类型).
+(n-1)H2O,该反应属于缩聚反应(填反应类型).