题目内容
5.X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )| A. | 原子半径由小到大的顺序:X<Y<Z<W | |
| B. | X氢化物的沸点高于Z氢化物的沸点 | |
| C. | 最高价氧化物对应水化物的酸性X大于Z | |
| D. | 室温下,0.1 mol/L W的气态氢化物的水溶液的pH>1 |
分析 X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Y为Al元素;Z原子的最外层电子数是次外层电子数的一半,Z为Si元素,X与Z位于同一主族,则X为C元素,Y、Z、W原子的最外层电子数之和为14,W原子最外层电子数为14-3-4=7,则W为Cl,据此解答.
解答 解:X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Y为Al元素;Z原子的最外层电子数是次外层电子数的一半,Z为Si元素,X与Z位于同一主族,则X为C元素,Y、Z、W原子的最外层电子数之和为14,W原子最外层电子数为14-3-4=7,则W为Cl.
A.同周期自左而右原子半径增大,一般电子层越多原子半径越多,故原子半径:X(C)<W(Cl)<Z(Si)<<Y(Al),故A错误;
B.非金属性X(C)>Z(Si),故X氢化物稳定性更强,故B错误;
C.非金属性X(C)>Z(Si),故最高价氧化物对应水化物的酸性X大于Z,故C正确;
D.室温下,0.1 mol/L HCl的水溶液的pH=1,故D错误,
故选:C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,综合考查元素化合物性质,注意常见既能与盐酸反应也能与NaOH溶液反应的物质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列说法错误的是( )
| A. | 碳酸钠固体中含有碳酸氢钠固体,可用灼烧的方法 | |
| B. | 用酚酞溶液可以鉴别饱和食盐水和饱和纯碱溶液 | |
| C. | 25℃,碳酸氢钠在水中的溶解度比碳酸钠的大 | |
| D. | 氢氧化钠与二氧化碳的反应与量有关 |
13.下列排序不正确的是( )
| A. | 原子半径:钠>硫>氯 | |
| B. | 最高价氧化物对应的水化物的酸性:H3PO4<H2SO4<HClO4 | |
| C. | 最高正化合价:氯>硫>磷 | |
| D. | 热稳定性:碘化氢>溴化氢>氯化氢 |
17.某种常见合金钢的合金元素主要是铬和镍,加入铬和镍的作用是( )
| A. | 增加抗腐蚀能力 | B. | 增加强度 | C. | 降低熔点 | D. | 增加延展性 |

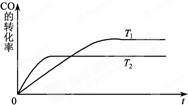 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题: .
.