题目内容
14. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:(1)在恒温时,向某密闭容器中通入2mol H2和1mol CO 气体,发生反应,压强一定时,测得在平衡时CH3OH的体积分数为0.5.与上述平衡保持同温、同压,若向密闭容器中通入4mol H2 (g)和2mol CO (g),达到平衡,则CH3OH的体积分数为0.5;平衡时,气体的总物质的量为3mol;该反应的平衡常数表达式K=$\frac{c(CH{\;}_{3}OH)}{{c}^{2}(H{\;}_{2})c(CO)}$;
此时CO的转化率为75%.
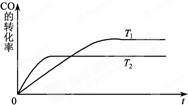
(2)图是该反应在不同温度下CO的转化率随时间变化的曲线.T1和T2温度下的平衡常数大小关系是K1>K2(填“>”、“<”或“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③H2O(g)═H2O(l)△H=-c kJ•mol-1
则CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1.
分析 (1)根据平衡时CH3OH的体积分数为0.5,利用三段式分析,可计算得平衡时各物质的物质的量,保持同温、同压加入的起始的物质的量为原来的2倍,得到的平衡为原平衡的等效平衡,根据平衡常数等于生成浓度的系数次幂之积除以反应物浓度系数次幂之积及转化率=$\frac{已转化的物质的量}{起始的物质的量}$×100%计算;
(2)根据图可知,CO的转化率在T2温度下低,据此判断平衡常数大小;
(3)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③H2O(g)═H2O(l)△H=-c kJ•mol-1
根据盖斯定律,将$\frac{①-②}{2}+③$×$\frac{1}{2}$得反应CH3OH(l)+O2(g)═CO(g)+2H2O(l),据此书写热化学方程式.
解答 解:(1)恒温时,密闭容器中通入2mol H2和1mol CO 气体发生反应达平衡,压强一定时CH3OH的体积分数为0.5,与上述平衡保持同温、同压,通入4mol H2 (g)和2mol CO (g),所以n (H2):n (CO)=2:1,与原反应一致,所以与原平衡为等效平衡,所以CH3OH的体积分数仍为0.5,设消耗CO物质的量为x,
CO(g)+2H2(g)?CH3OH(g),
起始物质的量(mol) 2 4 0
变化物质的量(mol) x 2x x
平衡物质的量(mol)2-x 4-2x x
根据题意有$\frac{x}{6-2x}$=0.5,所以x=1.5,平衡时,气体的总物质的量为(6-2x)mol=3mol,该反应的平衡常数表达式K=$\frac{c(CH{\;}_{3}OH)}{{c}^{2}(H{\;}_{2})c(CO)}$,CO的转化率为
$\frac{1.5}{2}$×100%=75%,
故答案为:0.5;3mol;$\frac{c(CH{\;}_{3}OH)}{{c}^{2}(H{\;}_{2})c(CO)}$;75%;
(2)根据图可知,CO的转化率在T2温度下低,此时平衡常数小,所以K1>K2,
故答案为:>;
(3)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③H2O(g)═H2O(l)△H=-c kJ•mol-1
根据盖斯定律,将$\frac{①-②}{2}+③$×$\frac{1}{2}$得反应CH3OH(l)+O2(g)═CO(g)+2H2O(l),所以△H=$\frac{b-a-4c}{2}$,
故答案为:$\frac{b-a-4c}{2}$.
点评 本题考查等效平衡的计算,题目难度中等,注意准确理解等效平衡的原理和应用.

| A. | 蜡炬成灰 | B. | 木已成舟 | C. | 铁柱成针 | D. | 滴水成冰 |
| A. | 原子半径由小到大的顺序:X<Y<Z<W | |
| B. | X氢化物的沸点高于Z氢化物的沸点 | |
| C. | 最高价氧化物对应水化物的酸性X大于Z | |
| D. | 室温下,0.1 mol/L W的气态氢化物的水溶液的pH>1 |
| A. | 能量的发展发段为:柴草时期→化石能源时期→多能源结构时期 | |
| B. | 化石燃料种类:煤、石油、天然气,特点:蕴藏量有限,且不能再生 | |
| C. | 新能源特点:资源丰富,可以再生,没有污染 | |
| D. | 我国目前使用的主要能源是:化石燃料,它们的蕴藏量有限,而且不能再生,最终将会枯竭 |
| A. | Fe+Cu2+═Fe2++Cu | |
| B. | Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | Cl2+H2O═H++Cl-+HClO | |
| D. | CO32-+2H+═CO2↑+H2O |

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快;直接蒸干BaCl2溶液能(填“能”或“不能”)得到BaCl2•2H2O晶体.
(2)
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9.
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H2O Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL.
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.BaCl2溶液的浓度为$\frac{b(V0-V1)}{y}$mol•L-1.
| A. | Na2CO3和H2SO4 | B. | NaAlO2和HCl | C. | Na2CO3和Ca(OH)2 | D. | KAl(SO4)2和NaOH |
 .
.