题目内容
16.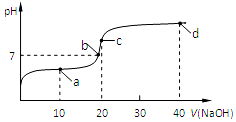 室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )| A. | a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | b点时:c(Na+)=c(CH3COO-) | |
| C. | c点时:c(OH-)=c(CH3COOH)+c(H+) | |
| D. | d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
分析 A.a点溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性,c(H+)>c(OH-),说明醋酸的电离程度大于醋酸根离子的水解程度;
B.b点时溶液的pH=7,c(H+)=c(OH-),根据电荷守恒判断;
C.c点时,恰好反应生成醋酸钠溶液,根据电荷守恒和物料守恒进行判断;
D.d点氢氧化钠过量,为NaOH和CH3COONa的混合物,溶液呈碱性.
解答 解:A.a点时醋酸过量,溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性,醋酸根离子的水解程度小于醋酸的电离程度,则c(CH3COO-)>c(CH3COOH),故A错误;
B.溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),b点时溶液的pH=7,呈中性,则c(H+)=c(OH-),根据电荷守恒可知c(Na+)=c(CH3COO-),故B正确;
C.c点时,氢氧化钠与醋酸恰好反应生成醋酸钠溶液,醋酸钠溶液中,根据电荷守恒可得:①c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒可得:②c(Na+)=c(CH3COO-)+c(CH3COOH),将②带入①可得:c(OH-)=c(CH3COOH)+c(H+),故C正确;
D.d点为NaOH和CH3COONa的混合物,氢氧化钠过量,溶液呈碱性,由于CH3COO-存在微弱的水解,则:c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D正确;
故选A.
点评 本题考查酸碱混合的判断和离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒、盐的水解判断溶液中离子浓度大小.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
7.不能作为判断氯、磷两种元素非金属性强弱的依据的是( )
| A. | 氧化性:Cl2>红磷 | B. | 单质沸点:红磷>C12 | ||
| C. | 氢化物稳定性:HC1>PH3 | D. | 酸性:HClO4>H3PO4 |
4.下列关于浓HNO3与浓H2SO4的叙述正确的是( )
| A. | 常温下遇铁都发生钝化 | B. | 常温下都能与铜反应产生氢气 | ||
| C. | 露置于空气中,溶液质量均不变 | D. | 露置于空气中,溶液浓度均不变 |
11.下列关于阳离子的说法中错误的是( )
①阳离子都是由一个金属原子失去电子而形成的
②非金属原子不能形成阳离子
③阳离子的电子排布一定与稀有气体相同
④阳离子的价态不会大于其原子的最外层电子数
⑤阳离子都是稳定结构,不会再失去电子.
①阳离子都是由一个金属原子失去电子而形成的
②非金属原子不能形成阳离子
③阳离子的电子排布一定与稀有气体相同
④阳离子的价态不会大于其原子的最外层电子数
⑤阳离子都是稳定结构,不会再失去电子.
| A. | ①④ | B. | ②④ | C. | ①②③ | D. | ①②③④⑤ |
1.《诗词大会》不仅弘扬了中国传统文化,还蕴含了许多化学知识.下列说法不合理的是( )
| A. | 李白的诗句:“日照香炉生紫烟,遥看瀑布挂前川.”生紫烟包含了物理变化 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,北宋沈括用胆矾炼铜的过程属于置换反应 | |
| C. | 唐末五代时期丹学著作《元妙道要略》中有云“以硫黄、雄黄台硝石并蜜烧之;焰起,烧手面及烬屋舍者”.描述的是丹药的制作过程 | |
| D. | 古剑沈卢“以济钢为刃,柔铁为茎干,不尔则多折断”. 济钢指的是铁的合金 |
8.下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 酸性HCl>H2S | 非金属性Cl>S |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | 向NaI溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈紫红色. | I-还原性强于Cl- |
| D | Na在Cl2中燃烧的生成物含离子键 | NaCl固体可导电 |
| A. | A | B. | B | C. | C | D. | D |
6.下列叙述正确的是( )
| A. | 常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 | |
| B. | 常温下,将pH=10的氨水稀释后,溶液中所有离子浓度都减小 | |
| C. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在:c (Na+)=c(A-)>c(OH-)=c(H+) |
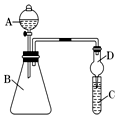 某学习小组同学利用如图装置来验证同主族元素非金属性的变化规律:
某学习小组同学利用如图装置来验证同主族元素非金属性的变化规律:


