题目内容
7.不能作为判断氯、磷两种元素非金属性强弱的依据的是( )| A. | 氧化性:Cl2>红磷 | B. | 单质沸点:红磷>C12 | ||
| C. | 氢化物稳定性:HC1>PH3 | D. | 酸性:HClO4>H3PO4 |
分析 比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱.
解答 解:A.单质的氧化性越强,其元素的非金属性越强,可以判断非金属性强弱,故A不选;
B.单质的沸点属于物理性质,与元素的非金属性无关,不能判断非金属性强弱,故B选;
C.氢化物的稳定性越强,则元素的非金属性越强,可以判断非金属性强弱,故C不选;
D.最高价氧化物对应的水化物酸性越强,其元素的非金属性越强,可以判断非金属性强弱,故D不选.
故选B.
点评 本题考查非金属性的比较,题目难度不大,注意元素非金属性和金属性的比较角度,学习中注意相关基础知识的积累,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
18.表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:氩.
(2)在这些元素中,属于金属的是:Na、Al.
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(4)最高价氧化物的水化物显两性的是氢氧化铝;写出它与盐酸反应的离子方程式Al(OH)3+3H+=Al3++3H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)在这些元素中,属于金属的是:Na、Al.
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(4)最高价氧化物的水化物显两性的是氢氧化铝;写出它与盐酸反应的离子方程式Al(OH)3+3H+=Al3++3H2O.
15.下列各组顺序的排列不正确的是( )
| A. | 熔点:金刚石>干冰 | B. | 离子半径:O2->Na+ | ||
| C. | 碱性:KOH>Al(OH)3 | D. | 稳定性:SiH4>H2S |
2.下列有关实验基本操作或现象的描述不正确的是( )
| A. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 | |
| B. | 溶剂蒸发的速率越快,或浓缩后的溶液冷却得越快,析出的晶体颗粒就越大 | |
| C. | 油脂在热NaOH溶液中完全水解后加入饱和食盐水,可观察到液面上有固体析出 | |
| D. | 制备NaCl晶体时,晶体表面含有少量KNO3,用水淋洗后可得到较纯净的NaC1 |
12.将0.1 mol•L-1的FeCl3溶液与0.lmol•L-1的KI溶液等体积混合充分反应:2FeCl3+2KI?2FeCl2+2KCl+I2,下列能证明该反应存在一定的反应限度的是( )
| A. | 溶液中能检测到Fe2+ | B. | 溶液中能检测到I2 | ||
| C. | 溶液中能检测到Fe3+ | D. | 溶液中能检测到Cl- |
19.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
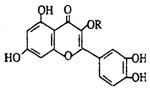

| A. | 可溶于有机溶剂 | B. | 分子中有三个苯环 | ||
| C. | 1mol维生素P可以和6molBr2反应 | D. | 1mol维生素P可以和4molNaOH反应 |
16.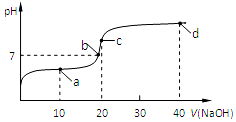 室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
 室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )| A. | a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | b点时:c(Na+)=c(CH3COO-) | |
| C. | c点时:c(OH-)=c(CH3COOH)+c(H+) | |
| D. | d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
17.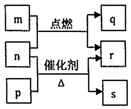 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:X<Y<Z | |
| B. | 非金属性:X>Y>Z | |
| C. | W、X、Y、Z四种元素可形成离子化合物 | |
| D. | q与s均为酸性氧化物,m的水溶液显酸性 |