题目内容
6.下列叙述正确的是( )| A. | 常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 | |
| B. | 常温下,将pH=10的氨水稀释后,溶液中所有离子浓度都减小 | |
| C. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在:c (Na+)=c(A-)>c(OH-)=c(H+) |
分析 A.醋酸抑制了水的电离,铵根离子涉及促进了水的电离;
B.氨水稀释后氢氧根离子浓度减小,水的离子积不变,则氢氧根离子浓度增大;
C.根据硫化钠溶液中的质子守恒判断;
D.pH为1的0.1 mol/L HA溶液,说明HA为强电解质,反应后生成强酸强碱盐NaA,溶液呈中性.
解答 解:A.常温下,pH=5的CH3COOH溶液中氢离子抑制了水的电离,而pH=5的NH4Cl溶液中铵根离子涉及促进了水的电离,所以两溶液中水的电离程度不同,故A错误;
B.常温下将pH=10的氨水稀释后,氢氧根离子浓度减小,由于水的离子积不变,则溶液中氢离子浓度增大,故B错误;
C.常温下0.1 mol/L Na2S溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),故C错误;
D.常温下,pH为1的0.1 mol/L HA溶液,则HA为强酸,与0.1 mol/L NaOH溶液恰好完全反应时恰好生成强酸强碱盐NaA,反应后溶液显示中性,则c (Na+)=c(A-)、c(OH-)=c(H+),溶液中离子浓度大小为:c (Na+)=c(A-)>c(OH-)=c(H+),故D正确;
故选D.
点评 本题考查较为综合,涉及弱电解质的电离平衡、盐的水解原理、离子浓度大小比较等知识,题目难度中等,明确电荷守恒、质子守恒及盐的水解原理的含义为解答关键,试题知识点较多,充分考查了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
16.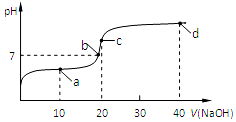 室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
 室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )| A. | a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | b点时:c(Na+)=c(CH3COO-) | |
| C. | c点时:c(OH-)=c(CH3COOH)+c(H+) | |
| D. | d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
17.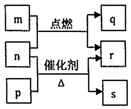 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:X<Y<Z | |
| B. | 非金属性:X>Y>Z | |
| C. | W、X、Y、Z四种元素可形成离子化合物 | |
| D. | q与s均为酸性氧化物,m的水溶液显酸性 |
14.制备异戊二烯流程如图所示.下列说法不正确的是( )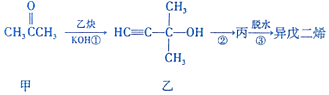

| A. | 甲分子中只有1种化学环境的氢原子 | |
| B. | 乙能发生加成反应、取代反应、消去反应 | |
| C. | 丙分子中的官能团有碳碳双键和羟基 | |
| D. | 上述每步转化属于消去反应 |
1.在1.01×105Pa、150℃时,将 ILCH4、2LC2H2、2LC3H6与30LO2混合并点燃,完全反应后,恢复至原来状态,气体的体积是( )
| A. | 35L | B. | 30L | C. | 25L | D. | 20 L |
5.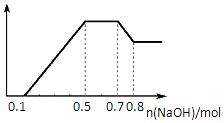 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中一定不含CO32-,可能含有SO42- | |
| B. | 溶液中n(NH4+)=0.2mol | |
| C. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
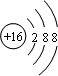
6.Na+、Mg2+、F-、O2-四种离子具有相同的电子层结构.则四种元素原子半径由大到小的顺序分别是( )
| A. | Mg>Na>F>O | B. | O>F>Na>Mg | C. | Na>Mg>O>F | D. | O>F>Na>Mg |
 ;
;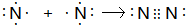 ;
;