题目内容
4.下列关于浓HNO3与浓H2SO4的叙述正确的是( )| A. | 常温下遇铁都发生钝化 | B. | 常温下都能与铜反应产生氢气 | ||
| C. | 露置于空气中,溶液质量均不变 | D. | 露置于空气中,溶液浓度均不变 |
分析 A、浓HNO3与浓H2SO4具有极强的氧化性,遇铁在铁的表面形成致密的氧化膜;
B、铜与浓硫酸常温下不反应,铜与浓硝酸生成二氧化氮,而不是氢气;
C、露置于空气中,浓H2SO4吸水性溶液质量增加;
D、露置于空气中,浓硝酸挥发,而浓硫酸吸水.
解答 解:A、浓HNO3与浓H2SO4具有极强的氧化性,遇铁在铁的表面形成致密的氧化膜,所以两者常温下遇铁都发生钝化,故A正确;
B、铜与浓硫酸常温下不反应,铜与浓硝酸生成二氧化氮,而不是氢气,故B错误;
C、露置于空气中,浓H2SO4吸水性溶液质量增加,而不是减轻,故C错误;
D、露置于空气中,浓硝酸挥发,而浓硫酸吸水,所以溶液浓度均变小,故D错误;
故选A.
点评 本题考查了物质的性质,熟悉浓硫酸、浓硝酸的性质是解题关键,题目难度不大,注意对基础知识的积累.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
14.某水溶液中含有以下离子中的若干种:K+、Cl-、Ca2+、Zn2+、CO32-、SO42-,现取两份溶液各100mL分别进行如下实验:
①第一份加入AgNO3溶液有沉淀产生
②第二份加足量BaCl2溶液后,得沉淀物6.63g,经足量硝酸洗涤、干燥后,沉淀质量为4.66g;在所得滤液中加入AgNO3溶液有沉淀产生
根据上述实验,以下有关原溶液的论断不正确的是( )
①第一份加入AgNO3溶液有沉淀产生
②第二份加足量BaCl2溶液后,得沉淀物6.63g,经足量硝酸洗涤、干燥后,沉淀质量为4.66g;在所得滤液中加入AgNO3溶液有沉淀产生
根据上述实验,以下有关原溶液的论断不正确的是( )
| A. | Cl-一定存在 | |
| B. | CO32-和SO42-一定存在,且二者的个数比为1:2 | |
| C. | Zn2+和Ca2+一定不存在 | |
| D. | 100mL溶液中K+的质量不小于2.34g |
15.下列各组顺序的排列不正确的是( )
| A. | 熔点:金刚石>干冰 | B. | 离子半径:O2->Na+ | ||
| C. | 碱性:KOH>Al(OH)3 | D. | 稳定性:SiH4>H2S |
12.将0.1 mol•L-1的FeCl3溶液与0.lmol•L-1的KI溶液等体积混合充分反应:2FeCl3+2KI?2FeCl2+2KCl+I2,下列能证明该反应存在一定的反应限度的是( )
| A. | 溶液中能检测到Fe2+ | B. | 溶液中能检测到I2 | ||
| C. | 溶液中能检测到Fe3+ | D. | 溶液中能检测到Cl- |
19.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
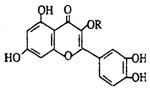

| A. | 可溶于有机溶剂 | B. | 分子中有三个苯环 | ||
| C. | 1mol维生素P可以和6molBr2反应 | D. | 1mol维生素P可以和4molNaOH反应 |
16.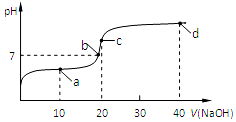 室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
 室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )| A. | a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | b点时:c(Na+)=c(CH3COO-) | |
| C. | c点时:c(OH-)=c(CH3COOH)+c(H+) | |
| D. | d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
14.制备异戊二烯流程如图所示.下列说法不正确的是( )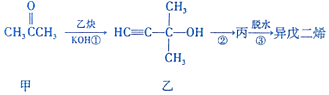

| A. | 甲分子中只有1种化学环境的氢原子 | |
| B. | 乙能发生加成反应、取代反应、消去反应 | |
| C. | 丙分子中的官能团有碳碳双键和羟基 | |
| D. | 上述每步转化属于消去反应 |
