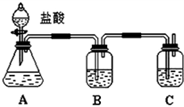
题目内容
18.在通常条件下,下列各组物质的性质排列不正确的是( )| A. | 还原性强弱:CI-<Br一<I - | B. | 微粒半径大小:S>Na+>O2- | ||
| C. | 热稳定性:HF>H2O>NH3 | D. | 碱性:KOH>NaOH>LiOH |
分析 A.非金属性越强,对应阴离子的还原性越弱;
B.电子层数越多,半径越大,相同层数,原子序数越小,半径越大;
C.非金属性越强,气态氢化物越稳定;
D.金属性越强,则对应的最高价氧化物的水化物的碱性越强.
解答 解:A.同主族从上到下非金属性依次减弱,非金属性越强,对应阴离子的还原性越弱,则还原性强弱为F-<Cl-<Br-<I-,故A正确;
B.由于钠离着O离着电子层数相同,原子序数O<Na,故半径:Na+<O2-,故B错误;
C.同周期从左到右非金属性依次增强,则非金属性F>O>N,所以气态氢化物的稳定性为HF>H2O>NH3,故C正确;
D.同主族从上到下金属性依次增强,则金属性K>Na>Li,则对应的最高价氧化物的水化物的碱性为KOH>NaOH>LiOH,故D正确,
故选B.
点评 本题考查非金属性和金属性的比较及元素周期律,熟悉非金属元素和金属元素的性质变化规律,及非金属性的比较方法即可解答,难度不大.

练习册系列答案
相关题目
9.关于如图所示的原电池,下列说法正确的是( )
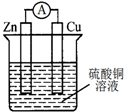

| A. | 电子从锌电极通过电流表流向铜电极 | |
| B. | 锌电极发生还原反应,铜电极发生氧化反应 | |
| C. | 反应后,锌电极的质量减小 | |
| D. | 铜电极作正极,发生的电极反应为2H++2e-═H2↑ |
6.下列有关三氧化硫的说法中,正确的是( )
| A. | 三氧化硫极易溶于水,且与水反应生成H2SO3 | |
| B. | SO3属于酸性氧化物 | |
| C. | 硫粉在过量的氧气中燃烧生成SO3 | |
| D. | SO2、SO3均具有漂白性,能使紫色石蕊溶液褪色 |
13.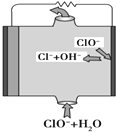 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )| A. | 镁燃料电池中镁均为负极,发生氧化反应 | |
| B. | 镁次氯酸盐燃料电池的总反应式为Mg+ClO-+H2O═Mg(OH)2+Cl- | |
| C. | 镁过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-═2H2O | |
| D. | 镁次氯酸盐燃料放电过程中OH-移向正极 |
3.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H=-192.9kJ•mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9kJ•mol-1 | |
| B. | CH3OH转变成H2的过程一定要吸收能量 | |
| C. | 可推知2H2(g)+O2(g)═2H2O(g)△H=-483.8 kJ/mol | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H<-192.9kJ•mol-1 |
10.如图表示某高分子化合物的结构片断,关于该高分子化合物的推断正确的是( )

| A. | 该高分子是经由缩聚反应得到 | |
| B. | 该高分子的分子式是(C3H3Cl3)n | |
| C. | 聚合物的单体是CHCl=CHClCH3 | |
| D. | 若n为聚合度,则其相对分子质量为97n |
7.NH3和BF3可以通过配位键形成化合物NH3•BF3.下列说法正确的是( )
| A. | NH3、BF3两分子都是极性分子 | |
| B. | NH3、BF3两分子的中心原子采取的都是sp3杂化 | |
| C. | 形成配合物时NH3中N原子提供的是孤对电子,BF3中B原子提供空轨道 | |
| D. | 形成配合物时BF3中B原子提供的是孤对电子,NH3中N原子提供空轨道 |
8.下列关于有机物的说法正确的是( )
| A. | 乳酸存在顺反异构 | B. | 乙苯可以通过苯与乙烷反应获得 | ||
| C. | 聚乙炔分子中含有碳碳双键 | D. | 对苯二酚可命名为1,3-苯二酚 |
 ,Y中含有的化学键类型是共价键.
,Y中含有的化学键类型是共价键.