题目内容
7.NH3和BF3可以通过配位键形成化合物NH3•BF3.下列说法正确的是( )| A. | NH3、BF3两分子都是极性分子 | |
| B. | NH3、BF3两分子的中心原子采取的都是sp3杂化 | |
| C. | 形成配合物时NH3中N原子提供的是孤对电子,BF3中B原子提供空轨道 | |
| D. | 形成配合物时BF3中B原子提供的是孤对电子,NH3中N原子提供空轨道 |
分析 A.对于ABn型分子,A原子的最外层电子,若完全成键,属于非极性分子,若不完全成键,则属于极性分子;
B.中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数;
C.NH3中N原子有孤对电子,BF3中B原子有空轨道;
D.NH3•BF3中B原子有空轨道,N原子有孤电子对.
解答 解:A.NH3中元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子,BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子,故A错误;
B.NH3中氮原子杂化轨道数=δ键数+孤对电子对数=3+1=4,所以采取sp3杂化,BF3中B形成3个δ键,无孤电子对,B原子杂化轨道数=σ键数+孤对电子对数=3+0=3,所以采取sp2杂化,故B错误;
C.NH3•BF3中B原子有空轨道,N原子有孤电子对,所以NH3提供孤电子对,BF3提供空轨道,形成配位键,故C正确;
D.NH3•BF3中B原子有空轨道,N原子有孤电子对,所以NH3提供孤电子对,BF3提供空轨道,形成配位键,使B、N原子都达到8电子稳定结构,故D错误;
故选C.
点评 本题考查了分子空间构型、分子极性、配位键等,难度不大,答题时注意B和N最外层电子数,是易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.常温下将稀KOH溶液和稀CH3COOH溶液混合,不可能出现的结果是( )
| A. | pH>7,且c(OH?)>c(K+)>c(H+)>c(CH3COO?) | B. | pH>7,且c(K+)+c(H+)=c(CH3COO?)+c(OH?) | ||
| C. | pH<7,且c(CH3COO?)>c(H+)>c(K+)>c(OH?) | D. | pH=7,且c(CH3COO?)=c(K+)>c(H+)=c(OH?) |
18.在通常条件下,下列各组物质的性质排列不正确的是( )
| A. | 还原性强弱:CI-<Br一<I - | B. | 微粒半径大小:S>Na+>O2- | ||
| C. | 热稳定性:HF>H2O>NH3 | D. | 碱性:KOH>NaOH>LiOH |
2.下列说法不正确的是( )
| A. | 甲烷和氯气反应生成一氯甲烷,其反应类型与苯和硝酸反应生成硝基苯的反应类型相同 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者都属于低聚糖 | |
| C. | 等质量的丙醇和乙酸完全燃烧时所需氧气的质量相同 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
12.下列关于粒子结构的描述不正确的是( )
| A. | H2S和NH3均是价电子总数为8的分子 | |
| B. | HS-和HCl均是含一个极性键的18电子粒子 | |
| C. | CO2的电子式为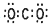 | |
| D. | 1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值) |
19.光照对下列反应几乎无影响的是( )
| A. | 氢气与氯气 | B. | 溴化银的分解 | C. | 甲烷与氧气 | D. | 次氯酸分解 |
16.下列有关粒子的表示方法正确的是( )
| A. | 氨气分子的电子式: | B. | 硫原子结构示意图: | ||
| C. | 氯气分子的结构式:Cl-Cl | D. | H2O的电子式: |
17.下列有关氨和硝酸实验的现象或结果,正确的是( )
| A. | 浓氨水滴进碱石灰里可制得氨气 | |
| B. | 蘸浓氨水和蘸浓硫酸的玻璃棒靠近会冒白烟 | |
| C. | 锌片与稀硝酸反应可制得氢气 | |
| D. | 铜片与浓硝酸反应可制得一氧化氮 |
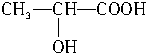
 +CO2↑+H2O
+CO2↑+H2O +2H2O.
+2H2O.