题目内容
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加快的是( )
| A、通入HCl气体 |
| B、不用铁片,改用铁粉 |
| C、滴加少量硫酸铜溶液 |
| D、加入KNO3固体 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:影响铁与稀硫酸反应的因素有浓度、温度、固体表面积大小以及原电池反应等,一般来说,增大浓度、升高温度、增大固体表面积或形成原电池反应都可增大反应速率.
解答:
解:A.通入HCl气体,溶液氢离子浓度增大,反应速率增大,故错误;
B.改用铁粉,固体表面积增大,反应速率增大,故B错误;
C.滴加少量硫酸铜溶液,铁置换出铜,形成原电池反应,反应速率增大,故C错误;
D.加入KNO3固体,由于酸性条件下硝酸根离子具有强氧化性,可与铁发生氧化还原反应生成NO而不生成氢气,故D正确.
故选D.
B.改用铁粉,固体表面积增大,反应速率增大,故B错误;
C.滴加少量硫酸铜溶液,铁置换出铜,形成原电池反应,反应速率增大,故C错误;
D.加入KNO3固体,由于酸性条件下硝酸根离子具有强氧化性,可与铁发生氧化还原反应生成NO而不生成氢气,故D正确.
故选D.
点评:本题考查化学反应速率的影响,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握影响化学反应速率的影响和影响原因,难度不大,注意相关基础知识的积累.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案
相关题目
下列说法中不正确的是( )
| A、大型中央空调的制冷剂可用液氨 |
| B、工业上用H2和N2合成氨与自然界中放电时O2和N2反应都属于氮的固定 |
| C、常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
| D、铵盐易溶于水,且可与强碱发生复分解反应 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B、常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| C、某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
| D、标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
下列有关化学用语表示正确的是( )
| A、氢的三种同位素:H2、D2、T2 |
B、F-的结构示意图: |
| C、中子数为20的氯原子:2017Cl |
D、NH3的电子式: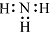 |
下列离子方程式表达正确的是( )
| A、0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |
| B、氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+ |
| C、Ca(HCO3)2溶液中滴加过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O |
分类法在化学学科的发展中起到非常重要的作用,下列分类标准合理的是( )
| A、根据酸分子中含有的H原子个数将酸分为一元酸,二元酸和多元酸 |
| B、根据反应中是否有离子参加化学反应分为离子反应和非离子反应 |
| C、根据水溶液是否能够导电,将物质分为电解质和非电解质 |
| D、根据是否含有氧元素,将物质分为氧化剂和还原剂 |
已知单质铁溶于一定浓度的HNO3溶液中反应的离子方程式为:aFe+bNO3-+cH+=dFe2++fFe3++gNO↑+hN2O↑+kH2O,化学计量数a~k均为正整数.则它们之间的关系正确的是( )
| A、c=4g+10h |
| B、c-2b=2d+3f |
| C、2d+3f=3g+8h |
| D、a+c=d+f |