题目内容
(1)在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的c(OH-)分别为a mol?L-1与b mol?L-1,则a与b的比值为
(2)甲、乙两学生同时加热滴有酚酞的小苏打溶液(粉红色),甲同学加热时,溶液红色变深,冷却到室温时又变回粉红色.乙同学加热后,红色也变深,冷却到室温,红色稍变浅但不能变到原粉红色,其原因是
.
(2)甲、乙两学生同时加热滴有酚酞的小苏打溶液(粉红色),甲同学加热时,溶液红色变深,冷却到室温时又变回粉红色.乙同学加热后,红色也变深,冷却到室温,红色稍变浅但不能变到原粉红色,其原因是
考点:pH的简单计算,影响盐类水解程度的主要因素
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)酸或碱抑制水电离,含有弱根离子的盐促进水电离,pH=9的氢氧化钠和醋酸钠,醋酸钠促进水电离,氢氧化钠抑制水电离,NaOH溶液中水电离出的c(OH-)=c(H+),醋酸钠溶液中水电离出的c(OH-)=
;
(2)小苏打是碳酸氢钠,甲加热只是促进了其水解,所以冷却后颜色变回;乙同学加热可能碳酸氢钠分解生成了碳酸钠,同时蒸发的溶剂多,溶液中氢氧根离子浓度大,所以冷却后未见原粉红色;
| KW |
| C(H+) |
(2)小苏打是碳酸氢钠,甲加热只是促进了其水解,所以冷却后颜色变回;乙同学加热可能碳酸氢钠分解生成了碳酸钠,同时蒸发的溶剂多,溶液中氢氧根离子浓度大,所以冷却后未见原粉红色;
解答:
解:(1)酸或碱抑制水电离,含有弱根离子的盐促进水电离,pH=9的氢氧化钠和醋酸钠,醋酸钠促进水电离,氢氧化钠抑制水电离,NaOH溶液中水电离出的c(OH-)=c(H+)=10-9 mol/L,醋酸钠溶液中水电离出的c(OH-)=
;=
mol/L=10-5 mol/L,所以a=10-4b,
故答案为:a=10-4b;
(2)碳酸氢钠为强碱弱酸盐,水解呈碱性,碳酸氢钠受热易分解,2NaHCO3
Na2CO3+CO2↑+H2O,碳酸钠为强碱弱酸盐,水解能力大于碳酸氢钠,所以同等条件下,碳酸钠碱性强于碳酸氢钠,小苏打是碳酸氢钠,甲加热只是促进了其水解,所以冷却后颜色变回;乙同学加热可能碳酸氢钠分解生成了碳酸钠,同时蒸发的溶剂多,溶液中氢氧根离子浓度大,所以冷却后未见变到原粉红色,
故答案为:甲乙两同学加热的时间不一样,由于乙加热的时间稍长,可能碳酸氢钠分解生成了碳酸钠,同时蒸发的溶剂多,溶液中氢氧根离子浓度大,所以冷却后未见变到原粉红色;
| KW |
| C(H+) |
| 10-14 |
| 10-9 |
故答案为:a=10-4b;
(2)碳酸氢钠为强碱弱酸盐,水解呈碱性,碳酸氢钠受热易分解,2NaHCO3
| ||
故答案为:甲乙两同学加热的时间不一样,由于乙加热的时间稍长,可能碳酸氢钠分解生成了碳酸钠,同时蒸发的溶剂多,溶液中氢氧根离子浓度大,所以冷却后未见变到原粉红色;
点评:本题考查了水的电离,由实验现象判定实验原理的逆向思维能力等,题目难度中等,明确哪些物质促进水电离、哪些物质抑制水电离是解本题关键,注意酸溶液中水电离出氢离子浓度、碱溶液中水电离出氢氧根离子浓度的方法,为易错点.

练习册系列答案
相关题目
下列关于强弱电解质的说法中,正确的是( )
| A、MgO在熔化状态下全部电离,是弱电解质 |
| B、具有极性键的共价化合物都是强电解质 |
| C、具有非极性键的共价化合物都是弱电解质 |
| D、所有弱酸、弱碱都是弱电解质 |
在酸性介质中,向MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生如下离子反应:2Mn2++5S2O82-+8X=2MnO42-+10SO42-+16H+,下列说法正确的是( )
| A、X是H2O |
| B、还原性:SO42->Mn2+ |
| C、该反应中酸性介质可以为盐酸 |
| D、每生成0.1molSO42-,转移电子0.05mol |
根据下列金属的熔沸点其中不能形成合金的是( )
| 金属 | Na | Cu | Al | Fe |
| 熔点(℃) | 97.5 | 1 083 | 660 | 1 535 |
| 沸点(℃) | 883 | 2 595 | 2 200 | 3 000 |
| A、Cu与Al |
| B、Fe与Cu |
| C、Fe与Na |
| D、Al与Na |
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加快的是( )
| A、通入HCl气体 |
| B、不用铁片,改用铁粉 |
| C、滴加少量硫酸铜溶液 |
| D、加入KNO3固体 |
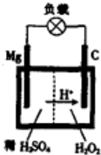 1808年,英国化学家用钾还原氧化镁,最早制得少量的镁.镁是航空工业的重要材料,镁作为一种强氧化剂,还用于钛、铍和铀的生产中.
1808年,英国化学家用钾还原氧化镁,最早制得少量的镁.镁是航空工业的重要材料,镁作为一种强氧化剂,还用于钛、铍和铀的生产中.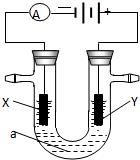 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: