题目内容
16.用Na2CO3固体配制1mol/L的Na2CO3溶液250mL.应称取碳酸钠固体的质量为26.5g;需要含结晶水的碳酸钠晶体(Na2CO3•10H2O)的质量为71.5g;需要物质的量浓度为4mol/L的Na2CO3溶液62.5mL.
分析 若用固体配制溶液,依据n=CV、m=nM计算需要溶质的物质的量和质量,若用浓溶液配制稀溶液,依据溶液稀释过程中溶质的物质的量不变,计算需要浓溶液的体积.
解答 解:用Na2CO3固体配制1mol/L的Na2CO3溶液250mL,则需要固体碳酸钠的物质的量n=1mol/L×0.25L=0.25mol;
若用固体碳酸钠配制,则需要碳酸钠的质量m=106g/mol×0.25mol=26.5g;
若用含结晶水的碳酸钠晶体(Na2CO3•10H2O)配制,则需要碳酸钠晶体质量m′=286g/mol×0.25mol/L=71.5g;
若用物质的量浓度为4mol/L的Na2CO3溶液配制,设需要4mol/L的Na2CO3溶液体积为V,依据溶液稀释过程中溶质的物质的量不变得:4mol/L×V=0.25mol,解得V=0.0625L,即62.5mL,
故答案为:26.5g; 71.5g; 62.5.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉以物质的量浓度为核心的运算是解题关键,题目难度不大.

练习册系列答案
相关题目
7.化学与生产、生活密切相关,下列说法不正确的是( )
| A. | “地沟油”是指从泔水中提取的油脂,它也是一种资源,但不能食用,可用于生产燃料油或用于制肥皂 | |
| B. | 媒体曝光的制造问题胶囊的工业明胶的主要成分是蛋白质 | |
| C. | 塑化剂DEHP是邻苯二甲酸(2─乙基己基)二酯,对人体无害可用作食品添加剂 | |
| D. | PM2.5是指大气中直径≤2.5×10-6m的颗粒物(气溶胶),可通过加水吸收后再用半透膜渗析的方法分离PM2.5微粒与可溶性吸附物 |
4.下列各组化合物中,化学键类型完全相同的是( )
| A. | CH4,H2O2,NH3 | B. | H2O,CO2,Na2O2 | C. | Na2O,NaCl,MgCl2 | D. | NaOH,NaClO,Na2O |
1.下列有关物质的性质与应用均正确的是( )
| A. | Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 | |
| B. | 乙烯能使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同 | |
| C. | Mg(OH)2难溶于水,但可缓慢溶于浓的NH4Cl溶液 | |
| D. | 油脂在酸性条件下可以水解,可用此反应可以制作肥皂 |
8.某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)步骤Ⅱ产生的气体是SO2.
(2)步骤Ⅲ中,“从反应后的混合物中分离出黑色沉淀”的操作是将反应后的混合物倒入装有冷水的烧杯中,冷却后过滤.
(3)该同学假设黑色沉淀是CuO.检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+.
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(4)再次假设,黑色沉淀是铜的硫化物.实验如下:
①现象2说明黑色沉淀具有还原性.
②产生红棕色气体的化学方程式是2NO+O2═2NO2.
③能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
④为确认黑色沉淀是“铜的硫化物”,还需进行的实验是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
(5)以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式为CuS+4H2SO4(浓)═CuSO4+4SO2↑+4H2O.
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)步骤Ⅱ产生的气体是SO2.
(2)步骤Ⅲ中,“从反应后的混合物中分离出黑色沉淀”的操作是将反应后的混合物倒入装有冷水的烧杯中,冷却后过滤.
(3)该同学假设黑色沉淀是CuO.检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+.
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(4)再次假设,黑色沉淀是铜的硫化物.实验如下:
| 实验装置 | 现象 |
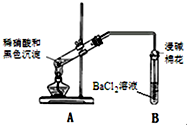 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
②产生红棕色气体的化学方程式是2NO+O2═2NO2.
③能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
④为确认黑色沉淀是“铜的硫化物”,还需进行的实验是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
(5)以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式为CuS+4H2SO4(浓)═CuSO4+4SO2↑+4H2O.
5.资料显示:
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究:
实验制备装置如图所示(省略夹持装置):
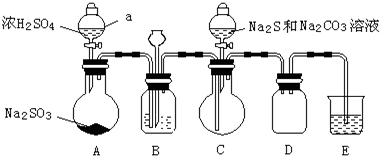
回答问题:
(1)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(2)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是观察B的气泡流速,旋转A分液漏斗活塞,通过控制硫酸流量而控制SO2流量.
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3?5H2O.
(4)完成对所得产品的检测的实验:
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究:
实验制备装置如图所示(省略夹持装置):

回答问题:
(1)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(2)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是观察B的气泡流速,旋转A分液漏斗活塞,通过控制硫酸流量而控制SO2流量.
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3?5H2O.
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S、Na2CO3 Na2SO4 及 Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3, 一定不含有Na2S、Na2SO4. |
6.10g甲物质和7g乙物质恰好完全反应,生成4.4g丙物质、1.8g丁物质和0.1mol戊物质,则戊物质的摩尔质量为( )
| A. | 100g•mol-1 | B. | 108g•mol-1 | C. | 55g•mol-1 | D. | 96g•mol-1 |
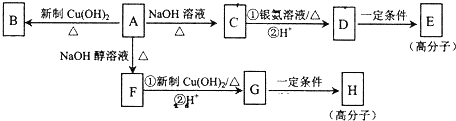
 .
.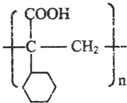 ,E的结构简式是
,E的结构简式是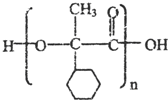 .
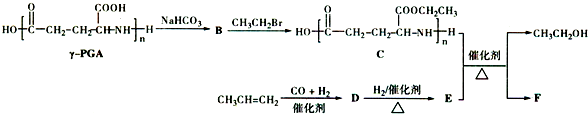
.
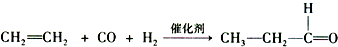
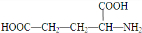 .
.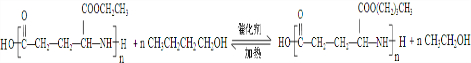 .
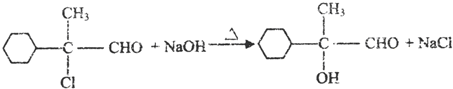
.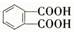 )反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.DBP有多种同分异构体,其中符合下列条件的DBP的同分异构体有12种,写出其中一种同分异构体的结构简式
)反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.DBP有多种同分异构体,其中符合下列条件的DBP的同分异构体有12种,写出其中一种同分异构体的结构简式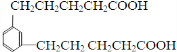 .
.