题目内容
10.根据离子方程式两边原子守恒和离子电荷总数相等原则..判定在离子反应xR++yH++O2═mR3++nH2O中,n的数值为2,m的数值为2.分析 反应xR++yH++O2═mR3++nH2O中,R的化合价升高,被氧化,O的化合价降低,被还原,根据氧化还原反应得失电子数目相等配平化学方程式,可求m,n值.
解答 解:反应xR++yH++O2═mR3++nH2O中,R的化合价有+1价升高为+3价,升高2价,O2的化合价由0价降低降低到-2价,降低4价,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等,故最小公倍数为4,故R+前系数为2并根据原子守恒配平方程式为2R++4H++O2=2R3++2H2O,故m=2,n=2,
故答案为:2;2.
点评 本题考查氧化还原反应,题目难度不大,注意从质量守恒和得失电子的角度解答,或直接配平方程式,也可得出m.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.Mg、Ca、Sr、Ba是按原子序数由小到大的顺序排列的第ⅡA族元素.已知:①Mg(OH)2难溶于水,而Ca(OH)2微溶于水;②MgSO4溶于水,而CaSO4微溶于水.下列推测中,不正确的是( )
| A. | Sr(OH)2溶解于水 | B. | SrSO4难溶于水 | ||
| C. | BaSO4不溶于水 | D. | Ba(OH)2比Ca(OH)2更难溶于水 |
18.将 3.84g Cu投入一定量的浓HNO3中,铜完全溶解,生成气体的颜色越来越淡,共收集到1134mL 气体(标准状况).再把盛有此气体的容器倒扣在水中,容器内液面上升,再通入标准状况下一定体积的氧气,恰好使气体完全溶于水中,则通入O2的体积是( )
| A. | 672 mL | B. | 168 mL | C. | 504 mL | D. | 224 mL |
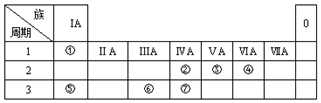
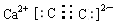 ,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.
,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.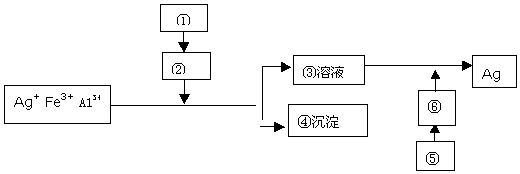
 为探究测定中和热的实验,小明利用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3kJ/mol).
为探究测定中和热的实验,小明利用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3kJ/mol).