题目内容
18.将 3.84g Cu投入一定量的浓HNO3中,铜完全溶解,生成气体的颜色越来越淡,共收集到1134mL 气体(标准状况).再把盛有此气体的容器倒扣在水中,容器内液面上升,再通入标准状况下一定体积的氧气,恰好使气体完全溶于水中,则通入O2的体积是( )| A. | 672 mL | B. | 168 mL | C. | 504 mL | D. | 224 mL |
分析 整个过程中HNO3$\stackrel{Cu}{→}$NO、NO2$\stackrel{O_{2}}{→}$HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,以此来解答.
解答 解:整个过程中HNO3$\stackrel{Cu}{→}$NO、NO2$\stackrel{O_{2}}{→}$HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,
设通入O2的体积为V,
则$\frac{3.84g}{64g/mol}$×(2-0)=$\frac{V}{22.4L/mol}$×2×(2-0),
解得V=0.672L=672mL,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握整个过程中元素的化合价变化、电子守恒为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度不大.

练习册系列答案
相关题目
15.生活中处处有化学,化学是人类进步的关键.下列表述错误的是( )
| A. | 低碳生活就是倡导低污染,低消耗,减少温室气体的排放 | |
| B. | 食用醋、医疗酒精、肥皂水三种溶液的pH逐渐增大 | |
| C. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,二者所用原理相同 | |
| D. | 久置的植物油会严生难闻的特殊气味,是由于植物油发生了变质 |
9.甲醇是重要的化学工业基础原料和液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
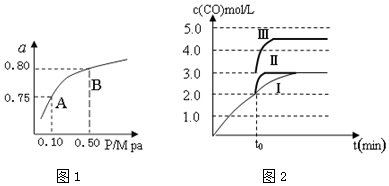
(3)500℃K3=2.5;反应③△H<0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)>v(逆) (填“>”“=”或“<”)
(4)一定温度下,在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).

(3)500℃K3=2.5;反应③△H<0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)>v(逆) (填“>”“=”或“<”)
(4)一定温度下,在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
6.在测定中和热的实验中,下列说法正确的是( )
| A. | 测量中和热时不能用金属棒搅拌混合溶液 | |
| B. | 中和热不是一个定值,其大小由中和反应所消耗的酸和碱的多少决定 | |
| C. | 50mL0.5mol/LHCl和50mL0.55mol/LNaOH溶液反应测定中和热,计算式为△H=$\frac{4.18×100}{0.025}$×△tKJ/mol (注:△t-温度平均变化量) | |
| D. | 为了减少误差,量取稀NaOH溶液后,立即用同一个量筒量取稀硫酸 |
3.下列实验操作完全正确的是( )
| 实验 | 操作 | |
| A | 用苯萃取碘水中碘后,静置后取出有机层 | 先从分液漏斗下端管口放出下层液体,关闭活塞,换一个接收容器,再继续从分液漏斗下端管口放出上层液体 |
| B | 配制500mL2mol/L的氯化铵溶液 | 用托盘天平称取53.5g氯化铵晶体放入500mL容量瓶,加少量水,振荡后再加水至刻度线 |
| C | 测定氯水的pH | 用玻璃棒蘸取少量溶液滴于pH试纸中央,片刻后与标准比色卡对照 |
| D | 用标准盐酸滴定未知浓度的NaOH溶液(含酚酞) | 左手控制酸式滴定管活塞使液体滴下,右手不断振荡锥形瓶,眼睛要始终观察锥形瓶中溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
 (1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系
(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系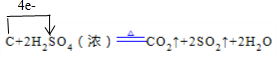 .
. 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一. 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题: