题目内容
5.在课外实验中,某学生用蔗糖、碳铵、生石灰和硫酸四种药品从AgNO3(内含少量Fe3+和A13+)溶液中提取银.如图所示,请回答下列问题.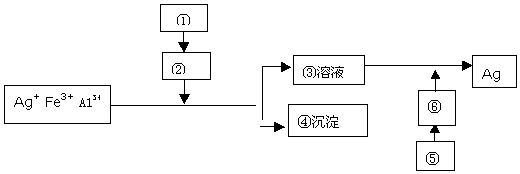
(1)写出方框中各物质的名称或化学式.
①NH4CO3、CaO ②NH3③[Ag(NH3)2]OH④A1(OH)3、Fe(OH)3⑤蔗糖、稀硫酸⑥葡萄糖
(2)写出生成沉淀④的离子方程式:3NH3•H2O+A13+=A1(OH)3↓+3NH4+、3NH3•H2O+Fe3+=Fe(OH)3↓.
(3)写出生成单质银的化学方程式:CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH$\stackrel{水浴}{→}$CH2OH(CHOH)4COOH+2Ag↓+H2O+4NH3.
分析 从含Fe3+和Al3+的AgNO3废液中提取银,利用①碳铵、生石灰加热反应生成②氨气,通入废液中沉淀铁离子、铝离子,银离子溶液与过量氨水生成③银氨溶液,沉淀为A1(OH)3、Fe(OH)3,蔗糖在稀硫酸作用下水解生成⑥为葡萄糖,葡萄糖和银氨溶液加热反应提取得到银单质,以此解答该题.
解答 解:(1)由以上分析可知①为NH4CO3、CaO;②为NH3; ③为[Ag(NH3)2]OH;④为A1(OH)3、Fe(OH)3;⑤为蔗糖、稀硫酸;⑥为葡萄糖,
故答案为:NH4CO3、CaO;NH3;[Ag(NH3)2]OH;A1(OH)3、Fe(OH)3;蔗糖、稀硫酸;
(2)反应④生成氢氧化铁、氢氧化铝沉淀,反应的离子方程式分别为3NH3•H2O+A13+=A1(OH)3↓+3NH4+、3NH3•H2O+Fe3+=Fe(OH)3↓,
故答案为:3NH3•H2O+A13+=A1(OH)3↓+3NH4+;3NH3•H2O+Fe3+=Fe(OH)3↓;
(3)葡萄糖与银氨溶液在水浴加热条件下发生反应生成银,反应的化学方程式为CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH $\stackrel{水浴}{→}$CH2OH(CHOH)4COOH+2Ag↓+H2O+4NH3,
故答案为:CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH $\stackrel{水浴}{→}$CH2OH(CHOH)4COOH+2Ag↓+H2O+4NH3.
点评 本题综合考查物质的分离、提纯,为高频考点,侧重考查学生的分析能力和实验能力,注意把握物质的性质,本题注意相关方程式的书写,难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
2.元素X、Y的原子序数之和为21,X3+与Y2-具有相同的核外电子排布,下列推测正确的是( )
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径:X>Y,离子半径:X3+>Y2- | |
| C. | 同族元素中Y的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
20.水是生命之源,下列有关各种“水”的说法中正确的是( )
| A. | 双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染 | |
| B. | 王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可以溶解Au、Pt | |
| C. | 新制备的氯水中存在七种粒子 | |
| D. | 氨水能导电,说明氨气是电解质 |
14.将8.985g 含少量氯化钠的碳酸氢钠固体加热一段时间,再加入足量盐酸完全反应.有关叙述正确的是( )
| A. | 固体分解越完全,消耗盐酸的量越少 | |
| B. | 共生成0.1mol二氧化碳,固体中氯化钠为5.85g | |
| C. | 固体中碳酸氢钠含量越多,钠元素的含量也越多 | |
| D. | 溶液中的钠离子为0.11mol,原固体中的碳酸氢钠为8.4g |
15.下列有关物质的性质与用途具有对应关系的是( )
| 性质 | 用途 | |
| A | 液氨气化吸热 | 可用作制冷剂 |
| B | NH4HCO3受热易分解 | 可用作氮肥 |
| C | 二氧化硅能与HF反应 | 可用作光导纤维 |
| D | 二氧化硫能使溴水褪色 | 可用作漂白剂 |
| A. | A | B. | B | C. | C | D. | D |
 (1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系
(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系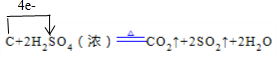 .
.