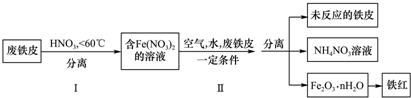
题目内容
17.下列有关氨的叙述中,不能用氢键的知识来解释的是( )| A. | 氨比磷化氢(PH3)稳定 | B. | 氨的沸点比磷化氢高 | ||
| C. | 氨气易溶于水 | D. | 液氨作制冷剂 |
分析 N、O、F元素的电负性较强,对应的氢化物可形成氢键,氢键是一种较强的分子间作用力,是由电负性强的原子(如F,O,N)对氢原子的吸引力产生的,能够影响物质的熔点、沸点、密度等,以此解答该题.
解答 解:A.元素的非金属性越强,其氢化物越稳定,所以氨比磷化氢(PH3)稳定,与氢键无关,故A选;
B.氨气分子之间能形成氢键,沸点高,所以氨的沸点比磷化氢高,故B不选;
C.氨气分子与水分子之间能形成氢键,则氨气极易溶于水,故C不选;
D.氨气分子之间能形成氢键,沸点高,因此易液化,液氨挥发会吸收大量的热,所以液氨可以作制冷剂,故D不选.
故选A.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
7.对于处于化学平衡状态的反应CO+H2O(g)?CO2+H2中,K正反应代表正反应的平衡常数,K逆反应代表逆反应的平衡常数,下列有关说法正确的是,( )
| A. | K正反应=K逆反应 | B. | K正反应>K逆反应 | ||
| C. | K正反应<K逆反应 | D. | K正反应×K逆反应=1 |
5.下列叙述正确的是( )
| A. | 将过量CO2气体通入水玻璃中可制得硅酸和纯碱 | |
| B. | 标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移电子0.1 mol | |
| C. | 1 L 2 mol•L-1明矾经水解可得到氢氧化铝胶体粒子数目为2×6.02×1023 | |
| D. | 漂白粉溶于水能导电,故漂白粉是电解质 |
12.已知:①A+B2+=A2++B,②D+2H2O=D(OH)2+H2↑,③以B、C为电极与C的盐溶液组成原电池,电极反应为:C2++2e-=C,B-2e-=B2+.则A2+、B2+、D2+、C2+的氧化性强弱关系是( )
| A. | D2+>A2+>B2+>C2+ | B. | C2+>B2+>A2+>D2+ | C. | D2+>C2+>A2+>B2+ | D. | A2+>B2+>D2+>C2+ |
2.下列分子中有关原子不满足最外层8电子稳定结构的是( )
| A. | 五氯化磷 | B. | 光气(化学式为:COCl2) | ||
| C. | 二硫化碳 | D. | 三氯化硼 |
6.关于金属的冶炼,下列说法正确的是( )
| A. | 通过电解饱和食盐水可制得单质Na | |
| B. | 工业上常用H2还原MgO制得单质Mg | |
| C. | 通过加热分解HgO可制得单质Hg | |
| D. | 用铝热法还原MnO2和Fe2O3,制得金属各1mol,消耗铝较少的是MnO2 |
7.某班同学完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了下列实验:
某温度下,取10g该溶液于烧杯中,滴入溶质质量分数为50%的K2CO3饱和溶液.滴入碳酸钾溶液质量与生成沉淀质量的关系如图所示.下列说法错误的是:( )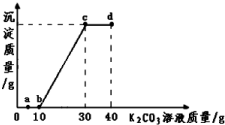
某温度下,取10g该溶液于烧杯中,滴入溶质质量分数为50%的K2CO3饱和溶液.滴入碳酸钾溶液质量与生成沉淀质量的关系如图所示.下列说法错误的是:( )

| A. | 向a点对应的溶液中滴加无色酚酞试液,溶液为无色 | |
| B. | 该温度下,K2CO3的溶解度为100g | |
| C. | 由图象可得,10g该溶液中氯化钙的质量约为8g | |
| D. | b、c、d三点对应的溶液中分别含有两种溶质 |