题目内容
5.下列叙述正确的是( )| A. | 将过量CO2气体通入水玻璃中可制得硅酸和纯碱 | |
| B. | 标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移电子0.1 mol | |
| C. | 1 L 2 mol•L-1明矾经水解可得到氢氧化铝胶体粒子数目为2×6.02×1023 | |
| D. | 漂白粉溶于水能导电,故漂白粉是电解质 |
分析 A.二氧化碳过量,反应生成硅酸和碳酸氢钠,无法得到纯碱碳酸钠;
B.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂;
C.氢氧化铝胶粒为氢氧化铝的聚集体;
D.漂白粉为混合物,不属于电解质和非电解质.
解答 解:A.纯碱为碳酸钠,而二氧化碳过量时,二者生成的是碳酸氢钠,故A错误;
B.标准状况下2.24 L Cl2的物质的量为1mol,1mol氯气过量稀NaOH溶液反应生成1mol氯化钠和1mol次氯酸钠,转移电子为0.1 mol,故B正确;
C.1 L 2 mol•L-1明矾经水解生成氢氧化铝胶体,由于氢氧化铝胶粒为氢氧化铝的聚集体,无法计算胶体中含有氢氧化铝胶体粒子的数目,故C错误;
D.漂白粉为氯化钙和次氯酸钙的混合物,所以漂白粉既不是电解质也不是非电解质,故D错误;
故选B.
点评 本题考查了物质的量的计算、电解质与非电解质的判断、胶体性质等知识,题目难度不大,注意掌握氯气与氢氧化钠溶液的反应实质,C为易错点,注意氢氧化铝胶粒为氢氧化铝的聚集体.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
16.化学在生产、生活中有着重要用途,下列对物质的用途、解释都正确的是( )
| 选项 | 物质 | 用途 | 解释 |
| A | H2O2 | 消毒剂 | H2O2具有强氧化性,可杀菌 |
| B | SiO2 | 计算机芯片 | SiO2是一种良好的半导体 |
| C | Fe3O4 | 红色涂料 | Fe3O4是一种红色氧化物 |
| D | 浓H2SO4 | 干燥剂 | 浓H2SO4有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
13.配制100mL 1mol/L NaOH溶液必须的仪器是( )
| A. | 量筒 | B. | 试管 | C. | 容量瓶 | D. | 分液漏斗 |
20.有七种物质:①甲烷、②苯、③聚乙烯、④聚异戊二烯、⑤2-丁炔、⑥环己烷、⑦环已烯,既能使酸性高锰酸钾溶液褪色.又能使溴水因反应而褪色的( )
| A. | ③④⑤ | B. | ④⑤ | C. | ④⑤⑦ | D. | ③④⑤⑦ |
17.下列有关氨的叙述中,不能用氢键的知识来解释的是( )
| A. | 氨比磷化氢(PH3)稳定 | B. | 氨的沸点比磷化氢高 | ||
| C. | 氨气易溶于水 | D. | 液氨作制冷剂 |
 .
.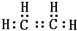 B的结构简式CH3CH2OH
B的结构简式CH3CH2OH
 .
.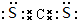 .
.