题目内容
2.下列分子中有关原子不满足最外层8电子稳定结构的是( )| A. | 五氯化磷 | B. | 光气(化学式为:COCl2) | ||
| C. | 二硫化碳 | D. | 三氯化硼 |
分析 分子中某原子最外层电子数=元素原子最外层电子数+该元素原子化合价绝对值,若该值等于8,则该原子满足8电子结构,据此分析解答.
解答 解:A.PCl5中Cl元素化合价为-1,Cl原子最外层电子数是7,1+7=8,P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,分子中P原子不满足8电子结构,故A选;
B.COCl2中C元素化合价为+4,C原子最外层电子数是4,4+4=8,O元素化合价为-2,原子最外层电子数为6,所以6+2=8,Cl原子最外层电子数是7,1+7=8,则都满足最外层8电子稳定结构,故B不选;
C.CS2为共价化合物,CS2分子中C元素化合价为+4,C原子最外层电子数是4,4+4=8,所以碳原子满足8电子结构,S元素化合价为-2,S原子最外层电子数是6,6+2=8,C、S原子均满足8个电子稳定结构,故C不选;
D.BCl3中Cl元素化合价为-1,Cl原子最外层电子数是7,1+7=8,B元素化合价为+3,B原子最外层电子数为3,所以3+3=6,分子中B原子不满足8电子结构,故D选;
故选AD.
点评 本题考查共价键,注意对8电子结构判断,分子中含有氢元素,该分子一定不满足各原子达8电子结构,题目难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
13.配制100mL 1mol/L NaOH溶液必须的仪器是( )
| A. | 量筒 | B. | 试管 | C. | 容量瓶 | D. | 分液漏斗 |
17.下列有关氨的叙述中,不能用氢键的知识来解释的是( )
| A. | 氨比磷化氢(PH3)稳定 | B. | 氨的沸点比磷化氢高 | ||
| C. | 氨气易溶于水 | D. | 液氨作制冷剂 |
11.卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它为原料按图所示工艺流程进行生产,可制得轻质氧化镁(已知其中有一种中间产物是MgCO3).

若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
表2原料价格表
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去.
(1)在步骤②中加入的试剂X,最佳的选择是漂液NaClO,其反应的离子方程式是2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
(2)在步骤③中如要控制pH=9.8,其目的是使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去;在步骤④中加入的试剂Z应该是Na2CO3;
(3)在步骤⑤中发生的化学方程式是MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.

若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
(1)在步骤②中加入的试剂X,最佳的选择是漂液NaClO,其反应的离子方程式是2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
(2)在步骤③中如要控制pH=9.8,其目的是使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去;在步骤④中加入的试剂Z应该是Na2CO3;
(3)在步骤⑤中发生的化学方程式是MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
12.在0.1mol/L NaHSO3溶液中存在着微粒浓度的关系式,正确的是( )
| A. | c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) | ||
| C. | c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | D. | c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
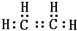 B的结构简式CH3CH2OH
B的结构简式CH3CH2OH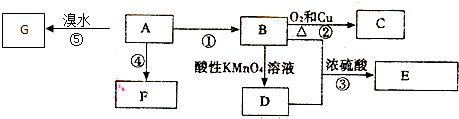
 .
.