题目内容
8.向Fe和Al2O3的混合物中加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )| A. | 通入过量Cl2:Cl-、SO42-、Fe2+、Al3+ | |
| B. | 加入过量NaOH溶液:SO42-、Na+、AlO2-、OH- | |
| C. | 加入过量氨水:NH4+、SO42-、Na+、AlO2- | |
| D. | 加入过量NaNO3溶液:NO3-、SO42-、Fe2+、Al3+ |
分析 加入过量硫酸溶解后过滤,滤液中含有的离子为:Fe2+、Al3+、SO42-、H+,
A.氯气Fe2+氧化生成Fe3+;
B.Fe2+、Al3+与NaOH反应;
C.加入氨水,可生成氢氧化铝沉淀;
D.酸性条件下硝酸根离子具有强氧化性.
解答 解:加入过量硫酸溶解后过滤,滤液中含有的离子为:Fe2+、Al3+、SO42-、H+,
A.氯气Fe2+氧化生成Fe3+,不能大量存在Fe2+,故A不选;
B.加入过量NaOH溶液,Fe2+转化为沉淀,Al3+转化为AlO2-,故B选;
C.加入氨水,可生成氢氧化铝沉淀,溶液不存在AlO2-,故C不选;
D.酸性条件下硝酸根离子具有强氧化性,Fe2+不能够大量共存,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息、离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
15.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1 molFeCl3水解生成的Fe(OH)3胶粒数为0.l NA | |
| B. | 标准状况下,2.24 L C10H22分子中共价键总数为31 NA | |
| C. | 电解精炼铜时,每转移l mol电子,阳极上溶解的铜原子一定小于0.5 NA | |
| D. | 25℃,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA |
16.4-溴甲基一1-环已烯的一种合成路线如下:
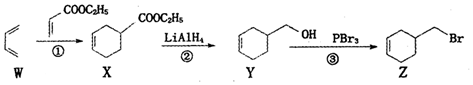
下列说法正确的是( )

下列说法正确的是( )
| A. | 烯烃W名称为1,3-丁二烯,所有原子一定在同一平面上 | |
| B. | ①、②、③的反应类型依次为加成反应、还原反应和取代反应 | |
| C. | 由化合物Z-步制备化合物Y的转化条件是:NaOH醇溶液,加热 | |
| D. | 化合物Y先经酸性髙锰酸鉀溶液氧化,再与乙醇在浓硫酸催化下酯化可得化合物X |
16.下列分子中,所有原子的最外层均为8电子结构的是( )
| A. | BeCl2 | B. | H2S | C. | CCl4 | D. | BF3 |
13.下列物质反应后出现黄色的是( )
| A. | 淀粉遇碘 | B. | 在新制氢氧化铜中加入葡萄糖溶液 | ||
| C. | 蛋白质与浓硝酸作用 | D. | 乙醇、乙酸和浓硫酸混合加热 |
20.白磷放入热的 CuSO4溶液中发生如下反应:11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4,则 160gCuSO4所氧化的磷的物质的量为( )
| A. | 0.2mol | B. | 0.3mol | C. | 0.4mol | D. | 0.5mol |
17. 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如图所示,则下表中X为( )
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如图所示,则下表中X为( )
 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如图所示,则下表中X为( )
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如图所示,则下表中X为( )| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | X | 499 | 434 |
| A. | 410 | B. | 335 | C. | 360 | D. | 188 |
18.下列变化化学键未被破坏的是( )
| A. | Cl2溶于水 | B. | NaCl固体熔化 | C. | H2与Cl2反应 | D. | 干冰气化 |


