题目内容
9.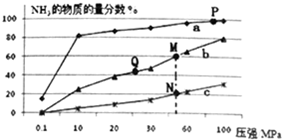 已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.
已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.(1)曲线a对应的温度是200℃.
(2)关于工业合成氨的反应,下列叙述正确的是ACE.
A.及时分离出NH3可以提高H2的平衡转化率
B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件
C.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
D.M点比N点的反应速率快
E.如果N点时c(NH3)=0.2mol•L-1,N点的化学平衡常数K≈0.93.
分析 (1)正反应是放热反应,升高温度平衡逆向移动,氨气的含量减小;
(2)A.减小生成物浓度平衡正向移动;
B.P点原料气的平衡转化率接近100%,但此时压强为100MPa,高压对设备的要求太高,导致成本高,不是当前工业生产工艺中采用的温度、压强条件;
C.K只受温度影响,温度不变平衡常数不变,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
D.温度越高反应速率越快;
E.计算平衡时各组分浓度,代入K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){•c}^{3}({H}_{2})}$计算平衡常数.
解答 解:(1)合成氨的反应为放热反应,反应温度越高,越不利于反应正向进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200°C;
故答案为:200℃;
(2)A.及时分离出NH3,可以使平衡正向进行,可以提高H2的平衡转化率,故A正确;
B.P点原料气的平衡转化率接近100%,但此时压强为100MPa,高压对设备的要求太高,导致成本高,当前工业生产工艺中采用的500℃、20MPa~50MPa,故B错误;
C.平衡常数与温度有关,与其他条件无关,温度相同时平衡常数相同,反应是放热反应,温度越高平衡常数越小,则M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故C正确;
D.N点温度高于M点,温度越低反应速率越快,故N点比M点的反应速率快,故D错误;
E.N点时c(NH3)=0.2mol•L-1,氨气体积分数为20%,则:
N2(g)+3H2(g)?2NH3(g)
起始浓度(mol/L):x 3x 0
变化浓度(mol/L):0.1 0.3 0.2
平衡浓度(mol/L):x-0.1 3x-0.3 0.2
所以$\frac{0.2}{4x-0.2}$=20%,解得x=0.3,平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){•c}^{3}({H}_{2})}$=$\frac{0.{2}^{2}}{0.2×0.{6}^{3}}$≈0.93,故E正确,
故选:ACE.
点评 本题考查化学平衡计算与影响因素、化学平衡图象等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算能力,题目难度中等.

①沙粒和硫粉 ②硫酸钠和硫粉 ③铁屑和硫粉 ④木炭和硫粉.
| A. | 用水溶解并过滤 | B. | 加热使硫粉升华并过滤 | ||
| C. | 用CS2溶解并过滤 | D. | 用盐酸溶解并过滤 |
| A. | 周期表中金属与非金属的分界线附近可以找到半导体 | |
| B. | 周期表中F是最活泼的非金属,Li是最活泼的金属 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共18个纵行 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
| A. | 为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 铝及其合金是电气、工业、家庭广泛使用的材料,通常用电解氯化铝的方法制取铝 | |
| D. | DNOP(邻苯二甲酸二辛酯)是一种由邻苯二甲酸和正辛醇经酯化反应而得的一种酯类有机化合物,常用作增塑剂、溶剂以及气相色谱固定液,对人体无害,可用作食品添加剂 |
| A. | LiCl | B. | NCl3 | C. | PCl5 | D. | BF3 |
①m+4 ②m-4 ③m-8 ④m+2⑤m-6 ⑥m+12.
| A. | ①②③ | B. | ①④⑤⑥ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
 已知N2和H2在一定条件下发生下列可逆反应:
已知N2和H2在一定条件下发生下列可逆反应: