题目内容
12.针对下表中十种元素,填写空格.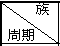 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅦA | ⅧA | O |
2 | N | O | F | |||||
3 | Na | Mg | Al | S | Cl | Ar | ||
4 | K |
(2)S原子结构示意图
 .
.(3)N、F、Cl中,原子半径最大的是Cl.
(4)最高价氧化物对应水化物酸性最强的是高氯酸(填名称).
(5)写出实验室制氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
分析 (1)稀有气体Ar最外层达到稳定结构,化学性质最不活泼;
(2)硫原子的核电荷数=核外电子总数=16,最外层含有6个电子;
(3)电子层越多,原子半径越大,电子层相同时核电荷数越大,原子半径越小;
(4)非金属性越强,最高价氧化物对应的水合物的酸性越强,F没有最高价,则Cl的最高价氧化物对应的水合物的酸性最强;
(5)实验室中用浓盐酸与二氧化锰加热反应制取氯气.
解答 解:(1)稀有气体最外层达到稳定结构,化学性质最不活泼,所以最不活泼的元素是Ar,
故答案为:Ar;
(2)S原子的核电荷数、核外电子总数都是16,其原子结构示意图为: ,
,
故答案为: ;
;
(3)N、F、Cl中,电子层最多的为Cl,则Cl原子的原子半径最大,
故答案为:Cl;
(4)由于F没有正价,则最高价氧化物对应水合物的酸性最强的为Cl,对应酸为高氯酸,
故答案为:高氯酸;
(5)实验室中制取氯气的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
点评 本题考查了位置结构与性质关系的综合应用,题目难度中等,明确原子结构与元素周期表、元素周期律的关系为解答关键,试题有利于培养学生的分析能力及灵活应用能力.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
2.放射性同位素电池采用的放射性同位素主要有${\;}_{38}^{90}Sr$等.下列关于${\;}_{38}^{90}Sr$的说法正确的是( )
| A. | 质子数为90 | B. | 中子数为38 | C. | 电子数为52 | D. | 质量数为90 |
3.如表实验操作正确且能达到预期目的是( )
| 实验目的 | 实验操作 | |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用等量的金属钠分别与水和乙醇反应 |
| B | 检验溴乙烷中含有溴元素 | 先加NaOH溶液共热,然后加入AgNO3溶液 |
| C | 证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液 |
| D | 除去苯中的少量苯酚 | 加入过量浓溴水,振荡后过滤 |
| A. | A | B. | B | C. | C | D. | D |
20.常见的有机反应类型有:①取代 ②加成 ③消去 ④酯化 ⑤加聚 ⑥水解 ⑦还原.其中能在有机化合物中引入-OH的反应类型有( )
| A. | ①②③④⑤⑥ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ②⑥⑦ |
17.下列各组物质中,化学键类型相同,化合物类型也相同的是( )
| A. | SO2 Na2SO4 | B. | CH4 H2O | C. | KCl HCl | D. | NaOH Cl2 |
4.有关 分子结构的叙述中正确的是( )
分子结构的叙述中正确的是( )
 分子结构的叙述中正确的是( )
分子结构的叙述中正确的是( )| A. | 分子中一定在同一平面上的碳原子至少为5个 | |
| B. | 分子中可能在同一平面上的碳原子最多为8个 | |
| C. | 分子中所有的碳原子有可能都在同一平面上 | |
| D. | 分子中在同一直线上的碳原子数为4 |
1.下列有关电池的叙述正确的是( )
| A. | 锌锰电池工作一段时间后外皮会变薄 | |
| B. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| C. | 如图所示电池工作时,负极溶解3g,溶液质量减轻0.2g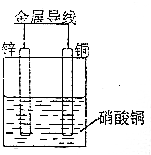 | |
| D. | 氢氧燃料电池工作时氢气在负极氧化 |
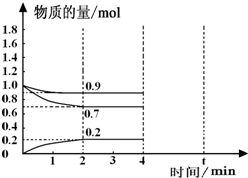 工业上合成合成氨的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
工业上合成合成氨的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol .
.